题目内容
17.下列说法正确的是( )| A. | 碱金属单质的密度随着原子序数的增大而增大 | |
| B. | 碱金属单质都是银白色金属 | |
| C. | 在周期表中金属与非金属的分界处,可以找到半导体材料 | |
| D. | 所有气体单质都含有非极性键 |
分析 A.碱金属的密度随着原子序数的递增逐渐增大,Na、K反常;
B.Li、Na、K、Rb等碱金属单质都是银白色;
C.在周期表中金属和非金属分界线处的元素具有金属性和非金属性;
D.稀有气体中不存在化学键.
解答 解:A.碱金属的密度随着原子序数的递增逐渐增大,Na、K反常,故A错误;
B.Li、Na、K、Rb等碱金属单质都是银白色,但Cs具有金属光泽,故B错误;
C.在周期表中金属和非金属分界线处的元素具有金属性和非金属性,所以可以找到半导体材料,故C正确;
D.稀有气体是单原子分子,稀有气体中不存在化学键,只存在分子间作用力,故D错误;
故选C.
点评 本题考查碱金属的结构和性质、元素周期表的应用、化学键等知识点,侧重考查学生分析推断能力,以碱金属为例熟练掌握同一主族元素性质递变规律,易错选项是D.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
8.下列物质的水溶液能导电,但属于非电解质的是( )
| A. | FeCl3 | B. | NH3 | C. | NH4HCO3 | D. | Cl2 |
2.有关化学用语正确的( )
| A. | 乙烯的结构简式:CH2CH2 | B. | NH4Cl的电子式: | ||
| C. | NH3的结构式为: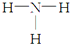 | D. | -CH3(甲基)的电子式为: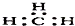 |
9.氨的合成是最重要的化工生产之一.
(1)工业上可用甲烷与水反应得到合成氨用的H2:其热化学反应方程式为CH4(g)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+3H2(g)△H4,已知有关反应的能量变化如图1所示:
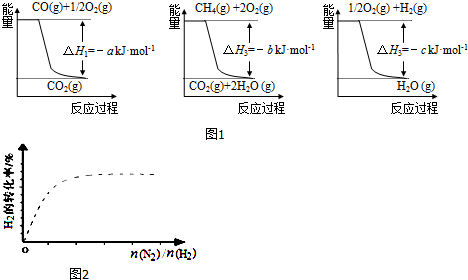
则△H4=(a+3c-b)kJ•mol-1(用a、b、c表示)
(2)在2个恒压的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g)$?_{催化剂}^{高温高压}$2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
①甲容器达到平衡所需要的时间t=5min(填“>”、“<”或“=”,下同);乙容器达到平衡时N2的浓度c=3mol•L-1.
②图2中虚线为该反应在使用催化剂条件下,关于起始N2与H2投料比和H2平衡转化率的关系图.当其他条件完全相同时,用实线画出不使用催化剂情况下H2平衡转化率的示意图.
(1)工业上可用甲烷与水反应得到合成氨用的H2:其热化学反应方程式为CH4(g)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+3H2(g)△H4,已知有关反应的能量变化如图1所示:

则△H4=(a+3c-b)kJ•mol-1(用a、b、c表示)
(2)在2个恒压的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g)$?_{催化剂}^{高温高压}$2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 |
| 达到平衡的时间(min) | t | 5 |
| 平衡时N2的浓度(mol•L-1) | 3 | c |
②图2中虚线为该反应在使用催化剂条件下,关于起始N2与H2投料比和H2平衡转化率的关系图.当其他条件完全相同时,用实线画出不使用催化剂情况下H2平衡转化率的示意图.
7.有关Na2CO3和NaHCO3的叙述中正确的是( )
| A. | Na2CO3和NaHCO3均可与澄清石灰水反应 | |
| B. | NaHCO3比Na2CO3热稳定性强 | |
| C. | 相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同 | |
| D. | Na2CO3俗名小苏打,NaHCO3俗名纯碱,其溶液均显碱性 |
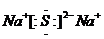 .
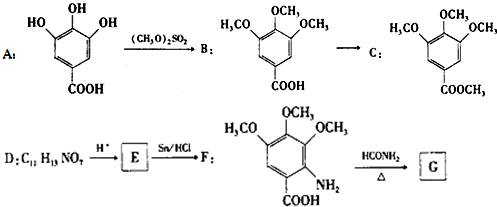
.
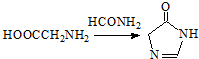
 .
. .
. .
.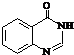 .合成过程中无机试剂任选.
.合成过程中无机试剂任选.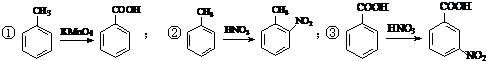 )
)
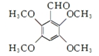
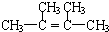 .
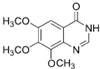
. 为不稳定结构.
为不稳定结构. .
. .
.