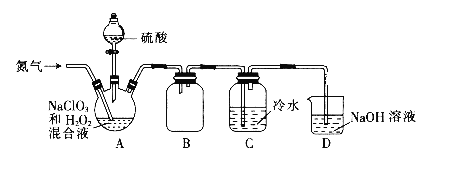
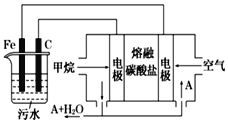
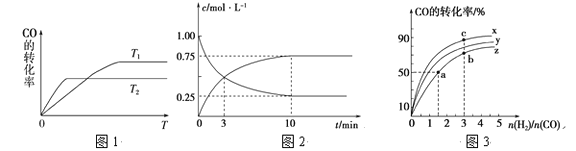
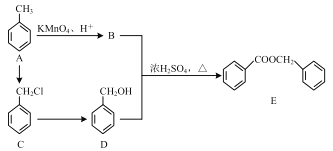
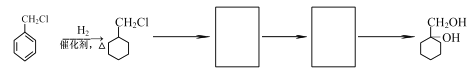
题目内容
【题目】A、B、C、D、E是前36号元素。其中A与B在周期表中位置相邻,A原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;B的基态原子有7种不同运动状态的电子;C原子在同周期原子中原子半径最大(稀有气体除外);D原子的L电子层中有两个未成对电子,且无空轨道;E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、D四种元素第一电离能从小到大顺序为_____。
(2)A的稳定氧化物中,中心原子的杂化类型为____,空间构型为_____。
(3)C与电负性最大的元素形成的化合物与B的氢化物熔沸点______更高,原因是_______。
(4)E的某种化合物的结构如图所示。
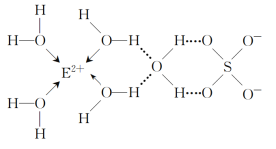
微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有____。
A: 离子键 B: 共价键 C: 配位键 D: 氢键
(5)元素金(Au)处于周期表中的第六周期,与E同族。一种E合金晶体具有立方最密堆积的结构,在晶胞中E原子处于面心,金原子处于顶点位置,则该合金中E原子与金原子数量之比为____;该晶体中,原子之间的作用力是_____。
(6)上述晶体具有储氢功能,氢原子可进入到由铜原子与金原子构成的四面体空隙中。若将铜原子与金原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式应为____。
【答案】C<O<N sp杂化 直线形 NaF NaF属于离子晶体,而NH3 属于分子晶体,离子键比氢键或范德华力强 ABCD 3∶1 金属键 Cu3AuH8
【解析】
由A原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍可知,A原子的电子排布式为1s22s22p2,为C原子;由B的基态原子有7种不同运动状态的电子可知,B的基态原子电子排布式为1s22s22p3,为N原子;由D原子的L电子层中有两个未成对电子,且无空轨道可知,D原子的电子排布式为1s22s22p4,为O原子;由C原子在同周期原子中原子半径最大(稀有气体除外),E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满可知,C原子的电子排布式为原子的电子排布式为1s22s22p63s1,为Na原子,E原子的电子排布式为原子的电子排布式为1s22s22p63s23p63d104s1,为Cu原子。
(1)C、N、O都为第二周期的非金属元素,同周期元素,从左到右第一电离能呈现增大的趋势,但由于氮原子的2p能级电子处于半充满的稳定状态,第一电离能大于相邻元素,则第一电离能从小到大顺序为C<O<N,故答案为:C<O<N;
(2)A的稳定氧化物为二氧化碳,二氧化碳中C原子的价层电子对数为2,孤对电子对数为0,则C原子的杂化方式为sp杂化,二氧化碳分子的空间构型为直线形,故答案为:sp杂化;直线形;
(3)电负性最大的元素为F元素,Na元素与F元素形成的化合物为离子化合物NaF,属于离子晶体,N元素的氢化物为共价化合物氨气,属于分子晶体,离子键比氢键或范德华力强,则离子晶体NaF的熔点高于分子晶体NH3 ,故答案为:NaF;NaF属于离子晶体,而NH3 属于分子晶体,离子键比氢键或范德华力强;
(4)由E的化合物的结构图可知,铜离子与水分子之间形成配位键,水分子之间以及水分子与硫酸根离子之间形成氢键,硫酸根离子中存在共价键,硫酸根离子与配离子之间形成离子键,则微粒间的相互作用包括化学键和分子间相互作用力为ABCD,故答案为:ABCD;
(5)铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则晶胞中Cu原子数目=6×![]() =3,晶胞中Au原子数目=8×
=3,晶胞中Au原子数目=8×![]() =1,则晶胞中Cu原子与Au原子数量之比为3:1;铜金合金晶体属于金属晶体,含有化学键类型为金属键,故答案为:3:1;金属键;
=1,则晶胞中Cu原子与Au原子数量之比为3:1;铜金合金晶体属于金属晶体,含有化学键类型为金属键,故答案为:3:1;金属键;
(6)CaF2的结构如图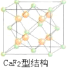 ,由题意可知氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,故答案为:Cu3AuH8。
,由题意可知氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,故答案为:Cu3AuH8。

 寒假学与练系列答案
寒假学与练系列答案【题目】现有短周期元素性质的部分数据如下表,其中x的值表示不同元素的原子吸引电子的能力大小,若x值越大,元素的非金属性越强,金属性越弱。x值相对较大的元素在所形成的分子中化合价为负。⑩原子的核外电子层数与核外电子总数相同。
元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
x | 3.44 | 2.55 | 0.98 | 3.16 | 2.19 | 3.98 | 0.93 | 3.04 | 1.91 | |
常见化合价 | 最高价 | +4 | +1 | +1 | +4 | |||||
最低价 | -2 | -1 | -3 | -1 | -3 | |||||
(1)根据以上条件,推断③④⑤的元素符号分别为:___,__,__。
(2)②的最高价氧化物的固体属于__晶体,空间构型__。
(3)用电子式表示下列原子相互结合成的化合物电子式:
①+⑦+⑩:___,
①+⑩形成原子个数比为1:1的化合物:__。
(4)写出①与⑦所形成仅含离子键的化合物和④与⑩所形成的化合物反应的离子方程式:___。