题目内容
(1)现有含Fe2O380%的赤铁矿100t,理论上可冶炼含Fe95%的生铁多少吨?
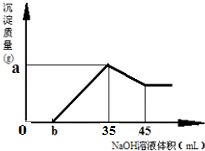
(2)准确称取6g铝土矿(含Fe2O3、Al2O3)样品,放入盛有100mLHCl的烧杯中,充分反应后过滤,向滤液中加入10mol?L-1的NaOH溶液,产生的沉淀的量与所加NaOH溶液的体积的关系如图所示.试求:
①盐酸的物质的量浓度是多少?
②若b=2.3,则铝土矿中氧化铝的质量分数是多少?
(2)准确称取6g铝土矿(含Fe2O3、Al2O3)样品,放入盛有100mLHCl的烧杯中,充分反应后过滤,向滤液中加入10mol?L-1的NaOH溶液,产生的沉淀的量与所加NaOH溶液的体积的关系如图所示.试求:
①盐酸的物质的量浓度是多少?
②若b=2.3,则铝土矿中氧化铝的质量分数是多少?

(1)由题目可知,m( Fe2O3)═100t×80%═80t
冶炼得到的铁的质量:m(Fe)═80t×(112÷160)═56t
故得到的含Fe95%的生铁的质量为:m═56t÷95%═58.9t
答:得到含Fe95%的生铁的质量为58.9t.
(2)由图象可知,加入氢氧化钠后过一段时间才出现沉淀,可知盐酸是过量的,Fe2O3、Al2O3均已完全反应为FeCl3、AlCl3,溶液中的溶质为:FeCl3、AlCl3、HCl.
待加入NaOH溶液35ml时,Fe3+、Al3+已恰好完全沉淀,溶液中的溶质只有NaCl,即n(Cl-)═n(Na+),∴n(HCl)═n(NaOH)═10mol?L-1×0.035L═0.35mol
∴c(HCl)═0.35mol÷0.1L═3.5mol?L-1
答:盐酸溶液的浓度为3.5mol?L-1
(3)由图象可知,生成的氢氧化铝溶解消耗的NaOH为10ml,设Al(OH)3为xmol
Al(OH)3 ~NaOH
1mol 1 mol
xmol 10mol?L-1×0.01L
解得x═0.1mol
而 2Al(OH)3 ~Al2O3 由此可知,n(Al2O3)═0.05mol
铝土矿中Al2O3的质量分数ω%═0.05mol×102g/mol÷6g×100%═85%
答:铝土矿中Al2O3的质量分数为85%.
冶炼得到的铁的质量:m(Fe)═80t×(112÷160)═56t
故得到的含Fe95%的生铁的质量为:m═56t÷95%═58.9t
答:得到含Fe95%的生铁的质量为58.9t.
(2)由图象可知,加入氢氧化钠后过一段时间才出现沉淀,可知盐酸是过量的,Fe2O3、Al2O3均已完全反应为FeCl3、AlCl3,溶液中的溶质为:FeCl3、AlCl3、HCl.
待加入NaOH溶液35ml时,Fe3+、Al3+已恰好完全沉淀,溶液中的溶质只有NaCl,即n(Cl-)═n(Na+),∴n(HCl)═n(NaOH)═10mol?L-1×0.035L═0.35mol
∴c(HCl)═0.35mol÷0.1L═3.5mol?L-1
答:盐酸溶液的浓度为3.5mol?L-1
(3)由图象可知,生成的氢氧化铝溶解消耗的NaOH为10ml,设Al(OH)3为xmol
Al(OH)3 ~NaOH
1mol 1 mol
xmol 10mol?L-1×0.01L
解得x═0.1mol
而 2Al(OH)3 ~Al2O3 由此可知,n(Al2O3)═0.05mol
铝土矿中Al2O3的质量分数ω%═0.05mol×102g/mol÷6g×100%═85%
答:铝土矿中Al2O3的质量分数为85%.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
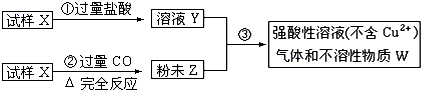
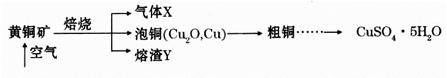


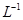 滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下:
滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下: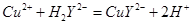 。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。
。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。