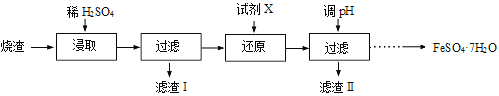
题目内容
【题目】将图1所示装置中的盐桥(琼脂-饱和![]() 溶液)换成铜导线与石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转。下列说法正确的是
溶液)换成铜导线与石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转。下列说法正确的是
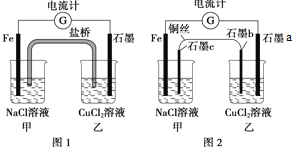
A. 图1中,铁棒质量减少5.6g,则甲池![]() 溶液的质量增加5.6g
溶液的质量增加5.6g
B. 图1中的石墨电极与图2中乙池石墨![]() 电极的电极反应式相同
电极的电极反应式相同
C. 两图所示装置的能量变化均是将化学能转化为电能
D. 图2中电子流向为![]() 电流计→石墨a→石墨b→铜丝→石墨c→
电流计→石墨a→石墨b→铜丝→石墨c→![]()
【答案】B
【解析】
A、图1中,铁棒质量减少5.6g,则甲池NaCl溶液的中增加了5.6g亚铁离子,而盐桥中的氯离子向甲中移动,所以甲池质量增加大于5.6g,故A错误;
B、图1为原电池,石墨上铜离子得电子生成Cu;图2中乙池为电解池,石墨a电极与负极Fe相连为阴极,阴极上铜离子得电子生成Cu,所以两个电极的反应相同,所以B选项是正确的;
C、图1中Fe与氯化铜溶液能自发发生氧化还原反应,则为原电池,将化学能转化为电能,图2中甲池是铁的吸氧腐蚀,发生氧化还原反应,则甲池为原电池,所以乙池为电解池,则乙池中电能转化为化学能,故C错误;
D、电子只在导线中移动,不能进入溶液,则图2中电子流向为:Fe→电流计→石墨a石墨b→铜丝→石墨c,故D错误。
所以B选项是正确的。

【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50mL0.50mol/L盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,混合均匀,测得混合液最高温度。
回答下列问题:
(1)写出该反应的热化学方程式(已知生成lmol液态水的反应热为-57.3kJ/mol)______________________。
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和 1L1mol/L盐酸恰好完全反应,其反应热分别为H1、H2、H3,则H1、H2、H3的大小关系为________________________。
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和反应后生成溶液的比热容c=4.18J/(g·℃),为了计算中和热,某学生实验记录数据如表:
实验序号 | 起始温度 | 终止温度 | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.4 | 20.6 | 23.6 |
4 | 20.1 | 20.3 | 26.9 |
依据该学生的实验数据计算,该实验测得的中和热H_____(结果保留一位小数)。
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量__________ (填“相等、不相等”),所求中和热__________(填“相等、不相等”)。
(5)利用简易量热计测量室温下盐酸与氢氧化钠溶液中和反应的反应热,下列措施不能提高实验精度的是(_______)
A.利用移液管(精确至0.01 mL)代替量筒(精确至0.1 mL)量取反应液
B.快速将两溶液混合,匀速搅拌并记录最高温度
C.在内、外筒之间填充隔热物质,防止热量损失
D.用量程为500℃的温度计代替量程为100℃的温度