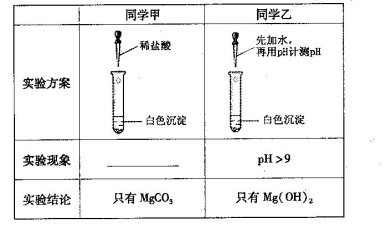
题目内容
碘是人体必需的微量元素之一,有“智力元素”之称。食用加碘食盐可预防碘缺乏病。查阅资料知:
①在酸性条件下,I-能被N 氧化成I
氧化成I ,被H2O2或O2等氧化成I2;
,被H2O2或O2等氧化成I2;
②I 能被HS
能被HS 还原成I2。
还原成I2。
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、I 中的哪一种。
中的哪一种。
限选试剂如下:1.0 mol·L-1 HNO3溶液、1.0 mol·L-1 H2SO4溶液、1.0 mol·L-1 NaHSO3溶液、3% H2O2溶液、1%淀粉溶液、蒸馏水
Ⅰ.提出假设
假设1:该食盐样品中含I2;
假设2:该食盐样品中含I-;
假设3: 。
Ⅱ .设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表。
| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液振荡 | 若溶液显 ,则假设1成立;否则,假设1不成立,再进行步骤2 |
| 步骤2: | 若溶液显蓝色,则假设2成立,反应的离子方程式为 ; 否则,假设2不成立,再进行步骤3 |
| 步骤3: | |
Ⅲ.问题与思考
纯的KIO3或KI都可以作为食用加碘盐中碘的来源。从化学角度来看,食盐中添加 (填“KIO3”或“KI”)更好;理由是 。
Ⅰ.假设3:该食盐样品中含I
Ⅱ.实验步骤 预期现象与结论 蓝色 取少量上述溶液注入试管中,滴入几滴1.0 mol·L-1 H2SO4溶液和几滴3% H2O2溶液后,再滴入几滴淀粉溶液,振荡 2I-+H2O2+2H+  I2+2H2O
I2+2H2O取少量上述溶液注入试管中,滴入几滴1.0 mol·L-1 NaHSO3溶液,再滴入几滴淀粉溶液,振荡 若溶液显蓝色,则假设3成立;否则,假设3不成立
Ⅲ.KIO3 KI在空气中易被氧气氧化成I2
解析

(15分)CoCl2·6H2O是一种饲料营养强化剂。一种利用水钻矿(主要成分为CO2O3、Co
(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
已知:①浸出液含有的阳离了主要有H+、CO2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01 mo1·L-l)
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)写出NaC1O3发生反应的主要离子方程式 ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“加Na2CO3调pH至a'’,过滤所得到的沉淀成分为____ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是 :其使用的最佳pH范围是____ 。
| A.2.0~2.5 | B.3.0~3.5 | C.4.0~4.5 | D.5.0~5.5 |
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)
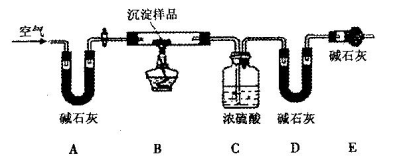
铁触媒(铁的氧化物)是合成氨工业的催化剂。某同学设计了以下两种方案研究铁触媒的组成。
方案一:用下列实验方法测定铁触媒的含铁量,确定其组成。
(1)步骤④中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和 。
(2)若通入Cl2不足量,溶液B中还含有 会影响测定结果。
(3) 若通入Cl2过量且加热煮沸不充分,溶液B中可能含有Cl2。请设计实验方案检验Cl2,完成下列实验报告。
限选试剂:0.1mol L-1酸性KMnO4溶液、紫色石蕊试液、淀粉-KI溶液、0.1mol L-1 KSCN溶液、 品红稀溶液
| 实验操作 | 实验现象与结论 |
| 取适量溶液B于试管中,滴加 ,振荡 ,放置一段时间后,观察现象。 | 若溶液 ,则溶液B中含Cl2; 若溶液 ,则溶液B中不含Cl2。 |

(4)干燥管C的作用是 。
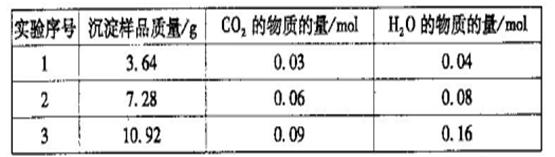
(5)称取15.2g铁触媒进行上述实验。充分反应后,测得干燥管B增重ll.0g,则该铁触媒的化学式可表示为 。
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
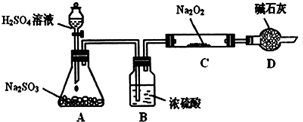
(1)实验室利用反应TiO2(s)+2CCl4(g)=TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下 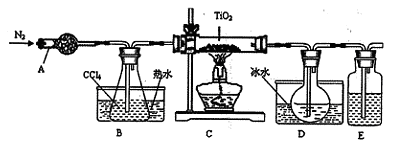
有关性质如下表
| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与 TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
仪器A的名称是____ ,装置E中的试剂是 。反应开始前必须进行的操作是____ ;反应结束后的操作包括:①停止通氮气②熄灭酒精灯③冷却至室温。正确的顺序为____ (填序号)。欲分离D中的液态混合物,所采用操作的名称是 。
(2)工业上由钛铁矿(FeTO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶:FeTiO3(s)+2H2SO4(aq)
水解;TiOSO4(aq)+2H2O(1)
简要工艺流程如下:

①试剂A为 。钛液I需冷却至70℃左右,若温度过高会导致产率降低,原因是 。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是____ ,写出其中发生氧化还原反应的离子方程式____ 。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是____ (填化学式)。
某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),设计了如下流程图: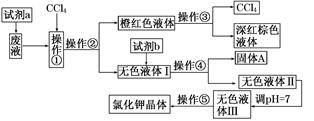
可供选择的试剂:饱和Na2CO3溶液,饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2溶液、KMnO4溶液(H+)、稀盐酸。
请根据流程图,回答相关问题:
(1)试剂a应该选用________。
(2)操作①②③④⑤的名称是________(填序号)。
| A.萃取、过滤、分液、过滤、蒸发结晶 |
| B.萃取、分液、蒸馏、过滤、蒸发结晶 |
| C.分液、萃取、过滤、过滤、蒸发结晶 |
| D.萃取、分液、分液、过滤、蒸发结晶 |
(4)调节pH的作用是________,操作方法是_____________________________________
________________________________________________________________________。
(5)操作⑤中用到的瓷质仪器名称是__________________________________________。
苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸。反应原理如下: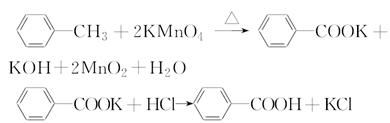
已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866 g·cm-3;苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3 g和6.9 g。
【制备产品】 30.0 mL甲苯和25.0 mL 1 mol·L-1高锰酸钾溶液在80℃下反应30 min,装置如图所示:
(1)图中支管的作用是_______________________。
(2)冷凝管的作用是________;进水口为________(填“a”或“b”)。
(3)相对于用酒精灯直接加热,用沸水浴加热的优点是________;在本实验中,三颈烧瓶最合适的容积是________(填字母)。
| A.50 mL | B.100 mL | C.200 mL | D.250 mL |
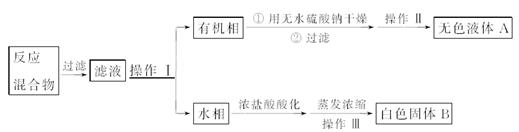
(4)操作Ⅰ的名称是________;含有杂质的产物经操作Ⅱ进一步提纯得无色液体A,则操作Ⅱ的名称是________。
(5)操作Ⅲ的名称是________。检验B中是否含有Cl-的方法如下:取少量B溶于水,在上层清液中滴加稀硝酸酸化的________溶液,若产生白色沉淀,则B中含有Cl-。