题目内容
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。
(1)上述3种气体直接排入空气后会引起酸雨的气体有 (填化学式)。
(2)早期人们曾经使用铅室法生产硫酸,其主要反应为:
SO2(g)+NO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
①若已知2SO2(g)+O2(g) 2SO3(g) ΔH=a kJ·mol-1
2SO3(g) ΔH=a kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=b kJ·mol-1
2NO2(g) ΔH=b kJ·mol-1
则SO2(g)+NO2(g) SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。
②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应:SO2(g)+NO2(g) SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
a.体系压强保持不变 b.混合气体的颜色保持不变
c.NO的物质的量保持不变 d.每生成1 mol SO3的同时消耗1 mol NO2
③测得②中反应5 min末到达平衡,此时容器中NO与NO2的体积比为3︰1,则这段时间内SO2的反应速率υ(SO2)= ,此反应在该温度下的平衡常数K= 。
(3)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g) CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
①上述合成甲醇的反应为 反应(填“放热”或“吸热”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 。
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为 ,理论上通过外电路的电子最多为 mol。
(1)(2分) SO2、NO2 (2)(8分)① ②ad ③0.075mol/(L?min) 9
②ad ③0.075mol/(L?min) 9
(3)(6分)①放热(1分) ②Ka=Kb>KC(1分) ③O2 + 2H2O + 4e-=4OH-(2分) 30(2分)
解析试题分析:(1)SO2和NO2排入大气中最终分别变为硫酸和硝酸,从而形成酸雨。CO不能形成酸雨。
(2)①若已知2SO2(g)+O2(g)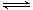 2SO3(g) ΔH=a kJ·mol-1、2NO(g)+O2(g)
2SO3(g) ΔH=a kJ·mol-1、2NO(g)+O2(g)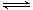 2NO2(g) ΔH=b kJ·mol-1,则根据盖斯定律可知前者减去后者即得到反应2SO2(g)+2NO2(g)
2NO2(g) ΔH=b kJ·mol-1,则根据盖斯定律可知前者减去后者即得到反应2SO2(g)+2NO2(g)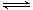 2SO3(g)+
2SO3(g)+
2NO(g),因此反应SO2(g)+NO2(g)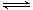 SO3(g)+NO(g) ΔH=
SO3(g)+NO(g) ΔH= kJ·mol-1。
kJ·mol-1。
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此可以判断。A、根据反应式可知,反应前后气体的体积不变,因此压强始终是不变,则体系压强保持不变不能说明反应达到平衡状态;b、颜色的深浅与NO2的浓度有关系,所以当混合气体的颜色保持不变时,则说明NO2的浓度不再发生变化,因此反应达到平衡状态;c、NO的物质的量保持不变说明正逆反应速率相等,达到平衡状态;d、每生成1 mol SO3的同时,一定消耗1 molNO2,因此该关系是始终成立的,不能说明反应达到平衡状态,答案选ad。
③ SO2(g)+NO2(g)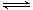 SO3(g)+NO(g)
SO3(g)+NO(g)
起始量(mol) 1 1 0 0
转化量(mol) x x x x
平衡量(mol) 1-x 1-x x x
由于平衡时容器中NO与NO2的体积比为3︰1
则3-3x=x
解得x=0.75mol
所以平衡时消耗SO2的浓度是0.75mol÷2L=0.375mol/L
则这段时间内SO2的反应速率υ(SO2)=0.375mol/L÷5min=0.075mol/(L?min)
由于反应前后体积不变,所以可以用物质的量代替浓度计算平衡常数
则此反应在该温度下的平衡常数K=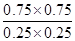 =9
=9
(3)①根据图像可知,在压强不变的条件下,随着温度的升高,CO的转化率降低。这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应。
②平衡常数只与温度有关系,A和B两点温度相同,则平衡常数相等。升高温度平衡向逆反应方向移动,平衡常数减小,所以三点平衡常数的大小关系是Ka=Kb>KC。
③原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应。所以在燃料电池中燃料在负极通入,氧气或空气在正极通入。由于电解质是氢氧化钾溶液,显碱性,所以正极电极反应式为O2 + 2H2O + 4e-=4OH-;根据图像可知A点CO的转化率是0.5,则平衡常数生成甲醇的物质的量是10mol×0.5=5mol。甲醇中碳元素的化合价是-2价,反应后被氧化为+4价,失去6个电子,所以5mol甲醇反应转移电子的物质的量是5mol×6=30mol。
考点:考查酸雨的形成、盖斯定律、反应速率和平衡常数计算、平衡状态判断、外界条件对平衡状态的影响以及电化学原理的应用与计算

甲醇是一种重要的化工原料。甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景。现有如下实验,在体积为1 L的密闭容器中,充入1mol CH3OH和1molH2O,一定条件下发生反应:CH3OH (g)+ H2O (g) CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。
CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。
| 时间 物质 | 0 min | 10 min | 30 min | 60 min | 70 min |
| CO2(mol/L) | 0 | 0.2 | 0.6 | 0.8 | 0.8 |
| CH3OH(mol/L) | 1.0 | 0.8 | 0.4 | 0.2 | 0.2 |
①已知:CH3OH (g)+
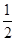 O2 (g)
O2 (g) CO2(g) + 2H2 (g) ?H1= —192.9kJ/mol
CO2(g) + 2H2 (g) ?H1= —192.9kJ/mol H2(g)+
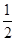 O2 (g)
O2 (g) H2 O(g) ?H2= —120.9kJ/mol
H2 O(g) ?H2= —120.9kJ/mol 则甲醇与水蒸气催化重整反应的焓变△H3=_____ 。
②10~30 min内,氢气的平均反应速率v(H2)=___________mol/(L·min)。
③该反应的平衡常数表达式为K=__________________。
④下列措施中能使平衡时n(CH3OH)/n(CO2)减小的是(双选)___________。
A.加入催化剂 B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离 D.再充入1molH2O
(2)甲醇在催化剂条件下可以直接氧化成甲酸。
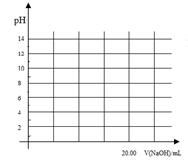
①在常温下,用0.1000 mol/L NaOH溶液滴定20. 00 mL 0.1000 mol/L 甲酸溶液过程中,当混合液的pH=7时,所消耗的V(NaOH)___(填“<”或“>”或“=”) 20. 00 mL。
②在上述滴定操作中,若将甲酸换成盐酸,请在图中的相应位置画出相应的滴定曲线。(1滴溶液约0.04mL)
铜单质及其化合物在工业生产和科研中有重要作用。
(1)已知:2Cu2O(s) + O2(g) = 4CuO(s)△H=-292kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式: ;
(2)现用氯化铜晶体(CuCl2·2H2O,含氯化亚铁杂质)制取纯净的CuCl2·2H2O。先将其制成水溶液,后按如图步骤进行提纯: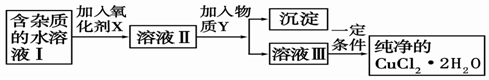
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表
| 金属离子 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
①现有氧化剂NaClO、H2O2、KMnO4,X加哪种好,为什么? ;
该反应的离子方程式为 。
②溶液II中除Cu2+外,还有 金属离子,如何检验其存在 。
③物质Y不能为下列的
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3 e.CaO f.NaOH
④若向溶液Ⅱ中加入碳酸钙,产生的现象是 。
氨有着广泛的用途,可用于化肥、硝酸、合成纤维等工业生产。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应可生成氨气: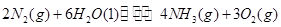
该反应在固定体积的密闭容器中进行,有关说法正确的是_____________(填序号字母)。
A.反应处于平衡状态时,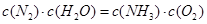 |
B.反应达到平衡后,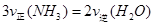 |
| C.体系的总压强不变,说明反应已达平衡 |
| D.混合气体的密度保持不变,说明反应已达平衡 |
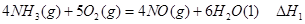 ①
①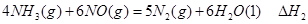 ②
②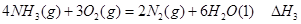 ③
③请写出上述三个反应中
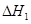 、
、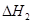 、
、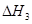 三者之间关系的表达式,
三者之间关系的表达式,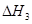 =_________。
=_________。(3)工业制硝酸的主要反应是:
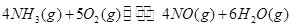
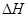 =
=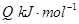
①升高温度,反应的K值减小,则Q______(填“>”、“<”或“=”)0。
②若反应起始的物质的量相同,下列关系图错误的是________(填序号)。


③在容积固定的密闭容器中发生上述反应,容器内部分物质的浓度如下表:
| 时间/浓度 |  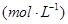 | 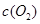 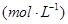 | 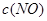 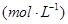 | 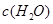 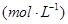 |
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | a | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
反应在第2 min到第4 min时,O2的平均反应速率为________。
反应在第2 min时改变了条件,改变的条件可能是______________________________。
该条件下,反应的平衡常数K=________。
以下是一些物质的熔沸点数据(常压):
| | 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:4 Na(g)+ 3CO2(g)
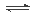 2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol
2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol(1)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min, 金属钠的物质的量减少了0.2mol,则10min内CO2的平均反应速率为 。
(2)高压下有利于金刚石的制备,理由是 。
(3)由CO2(g)+ 4Na(g)=2Na2O(s)+ C(s,金刚石) △H=-357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(l)的热化学方程式 。
(4)下图开关K接M时,石墨电极反应式为 。
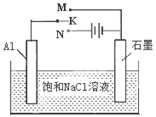
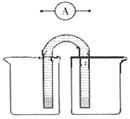
(5)请运用原电池原理设计实验,验证Cu2+、Ag+氧化性的强弱。
在方框内画出实验装置图,要求用烧杯和盐桥(在同一烧杯中,
电极与溶液含相同的金属元素),并标出外电路电子流向。
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g)  2NO(g) ΔH,已知该反应在 T ℃时,平衡常数K=9.0。
2NO(g) ΔH,已知该反应在 T ℃时,平衡常数K=9.0。
请回答:
(1)已知:N2(g)+2O2(g)  2NO2(g) ΔH1 2NO2(g)
2NO2(g) ΔH1 2NO2(g)  O2+2NO(g) ΔH2 ΔH= (用含ΔH1、ΔH2的表达式表示);
O2+2NO(g) ΔH2 ΔH= (用含ΔH1、ΔH2的表达式表示);
(2)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则NO的反应速率 ;
(3)假定该反应是在恒容条件下进行,下列能判断该反应已达到平衡的是________;
| A.消耗1 mol N2同时生成1 mol O2 |
| B.混合气体密度不变 |
| C.混合气体平均相对分子质量不变 |
| D.2v正(N2)=v逆(NO) |
 2NO(g)的“K-T”、“c(NO)-t”图,由图A可以推知该反应为 反应(填“吸热”或“放热”)。由图B可知,与a对应的条件相比,b改变的条件可以是 ;
2NO(g)的“K-T”、“c(NO)-t”图,由图A可以推知该反应为 反应(填“吸热”或“放热”)。由图B可知,与a对应的条件相比,b改变的条件可以是 ;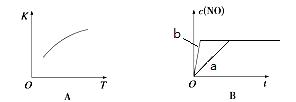
(5)T ℃时,某时刻测得容器内N2、O2、NO的浓度分别为0.20 mol·L-1、0.20mol·L-1和0.50mol·L-1,此时反应N2(g)+O2(g)
 2NO(g)________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),平衡时,N2在混合气体的体积百分数为多少?(在答题卡上写出具体计算过程,结果保留2位有效数字)
2NO(g)________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),平衡时,N2在混合气体的体积百分数为多少?(在答题卡上写出具体计算过程,结果保留2位有效数字)  O2(g)=CO(g)
O2(g)=CO(g) 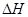 ="-111.0" KJ·mol-1
="-111.0" KJ·mol-1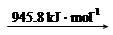 2N (g)
2N (g)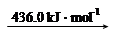 2H (g)
2H (g)
 (3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为: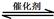 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
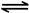 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol