题目内容
铜单质及其化合物在工业生产和科研中有重要作用。
(1)已知:2Cu2O(s) + O2(g) = 4CuO(s)△H=-292kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式: ;
(2)现用氯化铜晶体(CuCl2·2H2O,含氯化亚铁杂质)制取纯净的CuCl2·2H2O。先将其制成水溶液,后按如图步骤进行提纯: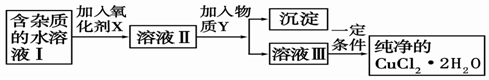
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表
| 金属离子 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
①现有氧化剂NaClO、H2O2、KMnO4,X加哪种好,为什么? ;
该反应的离子方程式为 。
②溶液II中除Cu2+外,还有 金属离子,如何检验其存在 。
③物质Y不能为下列的
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3 e.CaO f.NaOH
④若向溶液Ⅱ中加入碳酸钙,产生的现象是 。
(1)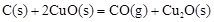 △H=+35.5kJ·mol-1(2分)
△H=+35.5kJ·mol-1(2分)
(2)①H2O2好,不引入杂质离子(2分)。
H2O2+2Fe2++2H+=2 Fe3++2H2O(2分)
②Fe3+(1分),取少量溶液于试管中,滴加KSCN溶液,若溶液变红色,证明含Fe3+。若溶液不变红色,则证明不含Fe3+。(2分)
③ef(2分)
④碳酸钙溶解,产生气泡和红褐色沉淀(1分)
解析试题分析:(1)先写出化学方程式并注明状态,然后根据盖斯定律求?H=-1/2?H1+1/2?H2=+35.5kJ·mol-1,进而写出热化学方程式。
(2)①NaClO、KMnO4,X作氧化剂,还原产物为新的杂质离子,H2O2作氧化剂被还原为H2O,不引入杂质离子,所以H2O2好;H2O2把Fe2+氧化为Fe3+,离子方程式为:H2O2+2Fe2++2H+=2 Fe3++2H2O
②H2O2把Fe2+氧化为Fe3+,溶液II中除Cu2+外,还有Fe3+;可用KSCN溶液检验Fe3+。
③物质Y的作用是调整pH,使Fe3+转化为Fe(OH)3沉淀, CaO 和NaOH会生成新的杂质离子Ca2+、Na+,所以Y不能为ef。
④CaCO3与H+反应生成CO2,pH增大,Fe3+转化为Fe(OH)3红褐色沉淀,所以反应现象为:碳酸钙溶解,产生气泡和红褐色沉淀。
考点:本题考查热化学方程式与盖斯定律的应用、反应物的选择、反应现象的判断、离子的检验、离子方程式的书写。

有效利用现有资源是解决能源问题的一种实际途径。发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值。下面是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程: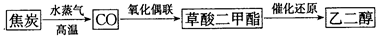
(1)该过程中产生的的CO可继续与水蒸气发生可逆反应得到CO2和H2,此反应的平衡常数表达式K=_____________。
(2)CH3OH(l)气化时吸收的热量为27kJ/mol,CH3OH(g)的燃烧热为677kJ/mol,请写出CH3OH(l)燃烧热的热化学方程式_____________。
(3)“催化还原”反应制乙二醇原理如下: CH3OOC—COOCH3(g)+4H2(g) HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
为探究实际生产的最佳条件,某科研小组进行了多方面研究。如图表示乙二醇达到平衡时的产率随原料投料比[n(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线丙对应的压强是P(丙)=_____________。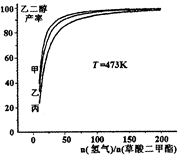
(4)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸①草酸氢钾溶液中存 在如下平衡: H2O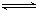 H++OH-、HC2O4-
H++OH-、HC2O4-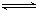 H++C2O42-和____________。
H++C2O42-和____________。
②向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液中各粒子浓度关系正确的是__________(填序号)。
| A.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-) |
| B.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-) |
| C.c(Na+)=c(H2C2O4)+c(C2O42-) |
| D.c(K+)>c(Na+) |
Ⅰ.沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是可持续发展的重要保证。 (1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入 (选填“Na2S”或“NaOH”)效果更好。
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
(3)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:

①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因 (任写一个)。
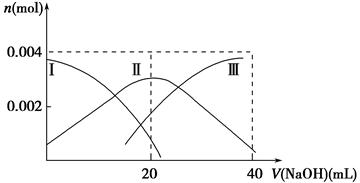
②某研究小组为探究提高含硫烟气中SO2吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图所示。
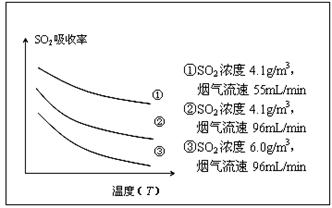
请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议: 。
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是 (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是 。
Ⅱ.能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式
①2H2(g)+O2(g)=2H2O(l)
 H=-570kJ/mol;
H=-570kJ/mol;②H2(g)+1/2O2(g)=H2O(g)
 H=-242kJ/mol;
H=-242kJ/mol;③C(s)+1/2O2(g)=CO(g)
 H=—110.5kJ/moL;
H=—110.5kJ/moL;④C(s)+O2(g)=CO2(g)
 H=—393.5kJ/moL;
H=—393.5kJ/moL;⑤CO2(g)+2H2O(g)=2CH4(g)+2 O2(g)
 H=+890kJ/moL
H=+890kJ/moL回答下列问题
(1)上述反应中属于吸热反应的是 。
(2)H2的燃烧热为△H= 。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s) + H2O(g)=H2(g)+ CO(g)
 H=akJ/moL;则a= ;该反应的熵
H=akJ/moL;则a= ;该反应的熵 S 0(选填“>”、“=”、“<”);已知自由能
S 0(选填“>”、“=”、“<”);已知自由能 G=
G= H—T
H—T S,当
S,当 G<0时可自发进行。则该反应在什么条件下可自发进行__________________。
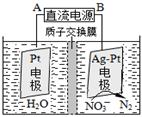
G<0时可自发进行。则该反应在什么条件下可自发进行__________________。(4)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是 。
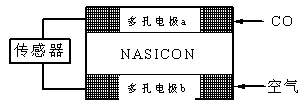
A.负极的电极反应式为:CO+O2—―2e-=CO2
B.工作时电极b作正极,O2—由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断,ΔH1______0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:__________。
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH1=-1451.6kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:
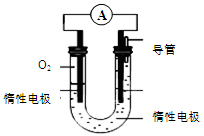
①该电池的能量转化形式为 。
②该电池正极的电极反应为 。
③工作一段时间后,测得溶液的pH减小,则该电池总反应的化学方程式为 。

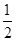 O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1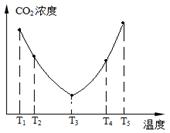
 SO3(g)+NO(g)
SO3(g)+NO(g)