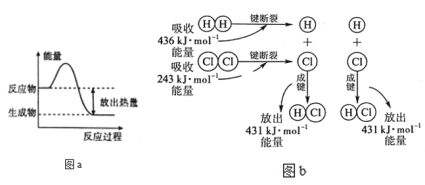
题目内容
【题目】配制一定物质的量浓度的NaOH溶液,下列操作会造成结果偏高的是( )
A.称量固体NaOH时,有潮解现象B.溶解后移液至容量瓶中,未冷却溶液
C.未将洗涤烧杯的水转移至容量瓶中D.定容时仰视读数
【答案】B
【解析】
A. NaOH潮解,会使称量的溶质质量偏小,溶液浓度偏低;
B. 溶解后移液至容量瓶中,未冷却溶液即定容,冷却后溶液体积变小,导致溶液浓度偏高;
C. 未将洗涤烧杯的水转移至容量瓶中,部分溶质没有转移入容量瓶,溶质变少,导致溶液浓度偏低;
D. 定容时仰视读数,加入的水过量,溶液体积变大,溶液浓度偏低;
故选B。

 阅读快车系列答案
阅读快车系列答案【题目】某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。

已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。
请回答:
(1)下列操作或描述正确的是__________。
A.步骤②,H2C2O4稍过量主要是为了抑制Fe2+水解
B.步骤③,采用热水洗涤可提高除杂效果
C.步骤③,母液中的溶质主要是(NH4)2SO4 和H2C2O4
D.步骤③,如果在常压下快速干燥,温度可选择略高于100℃
(2)如图装置,经过一系列操作完成步骤③中的抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):
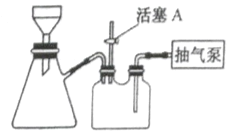
开抽气泵→a→b→d→_________→c→关抽气泵
a.转移固液混合物; b.关活塞A; c.开活塞A; d.确认抽干; e.加洗涤剂洗涤。
(3)称取一定量的FeC2O4·2H2O试样,用硫酸溶解,采用KMnO4滴定法测定,折算结果如下:
n (Fe2+)/mol | n (C2O42-)/mol | 试样中FeC2O4·2H2O的质量分数 |
9.80×10-4 | 9.80×10-4 | 0.980 |
由表中数据推测试样中最主要的杂质是___________
(4)实现步骤④必须用到的两种仪器是_________(供选仪器:a.烧杯;b.坩埚;c.蒸馏烧瓶;d.高温炉;e.表面皿;f.锥形瓶);该步骤的化学方程式是______________________。
(5)为实现步骤⑤,不宜用碳粉还原Fe2O3,理由是________________。