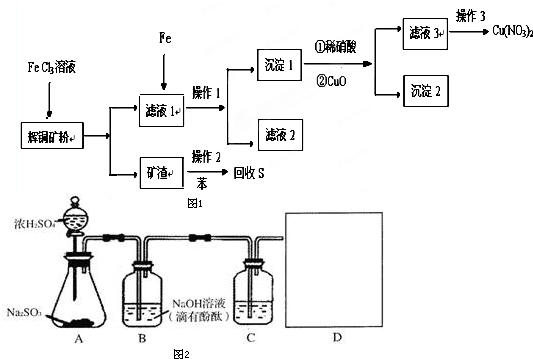
题目内容
12. 2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:
2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.
①写出该反应的平衡常数表达式$\frac{c(C{H}_{3}OC{H}_{3}).{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2}).{c}^{6}({H}_{2})}$.
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是BD.
A.容器中密度不变 B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2):v(H2)=1:3 D.容器内压强保持不变
(2)汽车尾气净化的主要原理为:2NO(g)+2CO(g) $\stackrel{催化剂}{?}$2CO2(g)+N2 (g)
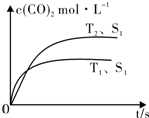
在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.据此判断:
①该反应的△H<0(选填“>”、“<”).
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线.
(3)已知:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ•mol-1.
①经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
(4)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势.氨在燃烧实验中相关的反应有:
4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H1 ①
4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H2 ②
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H3 ③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1=$\frac{3△{H}_{2}+2△{H}_{3}}{5}$.
(5)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置为用铂作为电极,加入KOH电解质溶液中,其电池反应为 4NH3+3O2=2N2+6H2O,写出该燃料电池的正极反应式O2+2H2O+4e-=4OH-.
分析 (1)①化学平衡常数K=$\frac{c(C{H}_{3}OC{H}_{3}).{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2}).{c}^{6}({H}_{2})}$;
②可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量不变,由此引起的一系列物理量不变;
(2)①根据先拐先平数值大知,T1>T2,升高温度,二氧化碳浓度降低,说明正反应是放热反应;
②催化剂只改变反应速率不改变平衡移动,所以平衡时二氧化碳浓度不变,但反应到达平衡的时间缩短;
(3)①该反应的浓度商=$\frac{0.8}{0.4×0.{4}^{2}}$=12.5>K,平衡逆向移动;
②根据表中数据知,20min时该反应达到平衡状态,恒温恒容条件下,反应前后气体物质的量之比等于其压强之比,反应后压强是反应前的0.70倍,则反应后气体物质的量=0.70×(1+2)mol=2.1mol,根据方程式知,参加反应的n(CO)为反应前后气体减少物质的量的一半,所以参加反应的n(CO)=(1+2-2.1)mol×$\frac{1}{2}$=0.45mol,据此计算其转化率;
(4)根据盖斯定律计算其反应热,从而确定三个焓变关系;
(5)燃料碱性电池中,正极上氧气得电子和水反应生成氢氧根离子.
解答 解:(1)①化学平衡常数K=$\frac{c(C{H}_{3}OC{H}_{3}).{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2}).{c}^{6}({H}_{2})}$,故答案为:$\frac{c(C{H}_{3}OC{H}_{3}).{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2}).{c}^{6}({H}_{2})}$;
②A.容器中气体质量不变、容器体积不变,所以容器中密度始终不变,则不能根据密度判断平衡状态,故错误;
B.单位时间内消耗2molCO2,同时消耗1mol二甲醚也同时生成1mol二甲醚,二甲醚正逆反应速率相等,该反应达到平衡状态,故正确;
C.无论反应是否达到平衡状态都存在v(CO2):v(H2)=1:3,所以不能据此判断平衡状态,故错误;
D.反应前后气体物质的量之和减小,所以反应前后气体压强改变,当容器内压强保持不变时,该反应达到平衡状态,故正确;
故选BD;
(2)①根据先拐先平数值大知,T1>T2,升高温度,二氧化碳浓度降低,说明正反应是放热反应,则焓变小于0,故答案为:<;
②催化剂只改变反应速率不改变平衡移动,所以平衡时二氧化碳浓度不变,但反应到达平衡的时间缩短,其图象为 ,
,
故答案为: ;
;
(3)①该反应的浓度商=$\frac{0.8}{0.4×0.{4}^{2}}$=12.5>K,平衡逆向移动,则正反应速率小于逆反应速率,故答案为:<;
②根据表中数据知,20min时该反应达到平衡状态,恒温恒容条件下,反应前后气体物质的量之比等于其压强之比,反应后压强是反应前的0.70倍,则反应后气体物质的量=0.70×(1+2)mol=2.1mol,根据方程式知,参加反应的n(CO)为反应前后气体减少物质的量的一半,所以参加反应的n(CO)=(1+2-2.1)mol×$\frac{1}{2}$=0.45mol,所以CO转化率=$\frac{0.45mol}{1mol}×100%$=45%,
故答案为:45%;
(4)由反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H1 ①
4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H2 ②
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H3③
则反应$\frac{3②+2③}{5}$可得到反应①,则△H1=$\frac{3△{H}_{2}+2△{H}_{3}}{5}$,故答案为:△H1=$\frac{3△{H}_{2}+2△{H}_{3}}{5}$;
(5)燃料碱性电池中,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-.
点评 本题考查较综合,涉及原电池原理、盖斯定律、化学平衡常数有关计算等知识点,为高频考点,只有反应前后改变的物理量才能作为平衡状态判断依据,难点是电极反应式的书写及平衡移动方向判断,题目难度中等.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案| A. | CaCO3+H2O+CO2═Ca(HCO3)2 | B. | AgNO3+NaCl═AgCl↓+NaNO3 | ||
| C. | Na2CO3+Ca(OH)2═CaCO3↓+2NaOH | D. | KCl+NaOH═NaCl+KOH |
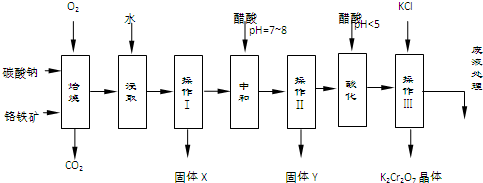
已知:①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3$\stackrel{750℃}{→}$2NaAlO2+CO2↑;
③Cr2O72-+H2O?2CrO42-+2H+
(1)固体X中主要含有Fe2O3、MgO(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用pH计或精密pH试纸(填写仪器或试剂名称).
(2)酸化步骤用醋酸调节溶液pH<5,其目的是使CrO42-转化为Cr2O72-.
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)右表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.该反应在溶液中能发生的理由是K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
 ),该反应可用来检验Cr2O72-的存在.写出反应的离子方程4H2O2+Cr2O72-+2H+═2CrO5+5H2O.该反应不属于(填“属于”或“不属于”)氧化还原反应.
),该反应可用来检验Cr2O72-的存在.写出反应的离子方程4H2O2+Cr2O72-+2H+═2CrO5+5H2O.该反应不属于(填“属于”或“不属于”)氧化还原反应.(6)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL2mol/L H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min.然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为94.08%.(保留3位有效数字,K2Cr2O7的摩尔质量为294g/mol).
| A. | NaOH和CH3COOH OH-+H+=H2O | |
| B. | 过量的CO2与NaOH溶液 CO2+2OH-=CO32-+H2O | |
| C. | Ba(OH)2+H2SO4=BaSO4+2H2O Ba2++SO42+=Ba SO4 | |
| D. | NaHS+HCl=NaCl+H2S HS++H+=H2S |
A.萃取分液 B.分液 C.蒸馏 D.过滤
①分离饱和食盐水与沙子的混合物 | ②分离水和汽油的混合物 | ③分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物,CCl4和甲苯互溶 | ④提取出碘水中的碘单质 |
| D | B | C | A |