题目内容
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。填写下列空白:
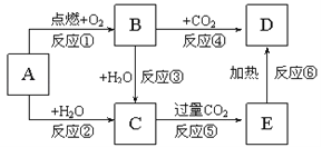
![]() 写出化学式:B__________,C______________,D __________________
写出化学式:B__________,C______________,D __________________
![]() 写出反应
写出反应![]() 的离子方程式:_______________________________________
的离子方程式:_______________________________________
![]() 写出反应
写出反应![]() 的化学反应方程式:_________________________________
的化学反应方程式:_________________________________
![]() 写出反应
写出反应![]() 的化学反应方程式,______________,若产生
的化学反应方程式,______________,若产生![]() 氧化产物,被还原的物质是__________,其物质的量是____mol,转移的电子数目______
氧化产物,被还原的物质是__________,其物质的量是____mol,转移的电子数目______
【答案】Na2O2 NaOH Na2CO3 ![]()
![]() 2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2 ![]()
![]()
![]()
【解析】
A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色,则A是Na,根据转化关系知,B是Na2O2、C是NaOH、D是Na2CO3、E是NaHCO3,以此解答该题。
(1)通过以上分析知,B是Na2O2,C是NaOH,D是Na2CO3;答案为Na2O2,NaOH,Na2CO3。
(2)NaOH溶液和过量二氧化碳反应生成碳酸氢钠,其离子方程式为CO2+OH-=HCO3-;答案为CO2+OH-=HCO3-。
(3)NaHCO3受热分解,生成Na2CO3、CO2和H2O,其化学方程式为2NaHCO3 ![]() Na2CO3+CO2↑+H2O;答案为2NaHCO3
Na2CO3+CO2↑+H2O;答案为2NaHCO3 ![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
(4)反应④是Na2O2与CO2反应生成Na2CO3和O2,其化学方程式为2Na2O2+2CO2=2Na2CO3+O2,根据此化学方程式分析,4个-1价的氧,2个失2个电子化合价升高到0价为O2,2个得2个电子变成-2价氧,因而Na2O2既是氧化剂又是还原剂,且2摩尔的Na2O2中有1摩尔氧化剂,1摩尔还原剂,O2是氧化产物,被还原的物质是Na2O2,若产生![]() 氧化产物,被还原的Na2O2也是0.5mol,生成1molO2,转移2mol电子,生成0.5molO2,转移的电子为1摩尔,即转移的电子数目为NA个;答案为2Na2O2+2CO2=2Na2CO3+O2,Na2O2,0.5mol,NA。
氧化产物,被还原的Na2O2也是0.5mol,生成1molO2,转移2mol电子,生成0.5molO2,转移的电子为1摩尔,即转移的电子数目为NA个;答案为2Na2O2+2CO2=2Na2CO3+O2,Na2O2,0.5mol,NA。