题目内容
【题目】有原子序数依次增大的A、B、C、D、E五种前四周期元素,B元素原子有三个能级,且每个能级上的电子数相等;C原子的p轨道处于半充满状态,D的单质是空气的主要成分之一,其质子数为A与C之和;E在周期表中位于ds区,且与D可形成化学式为E2D或ED的二元化合物。请回答下列问题:
(1)E元素基态原子的M能层中具有_____个能级,该元素的常见化合价有多种,其中E+的简化电子排布式为__________。
A.[Ar]3d104s1 B.[Ar]3d10 C.[Ar]3d94s1 D.[Ar]3d84s2
(2)元素C和D的原子的第一电离能较大的为__________(填元素符号),其原因是____________________;C与A可形成一种常见的气态化合物,该化合物的空间构型为____________________,其中C原子的杂化轨道类型为____________________。
(3)C2在日常生活及工农业生产等领域用途非常广泛,其分子结构中σ键和π键数目之比是_______;C2D与BD2互为__________(填“等电子体”或“非等电子体”),其理由是____________________。
(4)在E催化下,分子式为BA4D的化合物可被氧化为分子式为BA2D的化合物,则BA2D分子中键角约为__________;BA4D和BA2D两化合物均易溶于水,是由于与水分子间形成了__________键的缘故。
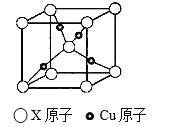
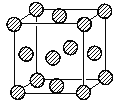
(5)元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为__________;元素B的单质晶体结构有多种,其中一种硬度很大,结构如下图,则该单质晶体的熔点_______E单质晶体的熔点(填“高于”或“低于”);若B单质的原子(如图中A、B两原子)在体对角线上外切,晶胞参数为a,则该晶体的空间利用率约为__________。(百分数表示,取两位有效数字)(已知![]() =1.732)
=1.732)

【答案】3 B N N原子的2p轨道为半充满的稳定结构,较难失电子,故其第一电离能较大 三角锥形 sp3杂化 1:2 等电子体 二者的价电子总数和原子总数相等 120。 氢 2:1 高于 34%
【解析】
A、B、C、D、E为原子序数依次增大的五种前四周期元素,B元素原子有三个能级,且每个能级上的电子数相等,则B元素原子的核外电子排布为1s22s22p2,则B原子核外共6个电子,为C元素;C原子的p轨道处于半充满状态,则C为N元素或P元素或As元素,D的单质是空气的主要成分之一,则D为N元素或O元素,又D的质子数为A与C之和,则A为H元素,C为N元素,D为O元素;E在周期表中位于ds区,且与D可形成化学式为E2D或ED的二元化合物,则E为Cu元素,其与O形成化合物Cu2O或CuO,据此分析解答。
由以上分析知,A为H元素,B为C元素,C为N元素,D为O元素,E为Cu元素,
(1)E为Cu元素,其为29号元素,根据构造原理可写出其电子排布式为1s22s22p63s23p63d104s1,则Cu元素基态原子的M能层中具有3个能级,其中Cu+的简化电子排布式为[Ar]3d10,故答案为:3;B;
(2)C为N元素,D为O元素,由于N原子的2p轨道为半充满的稳定结构,较难失电子,故N原子的第一电离能较大;A为H元素,C与A可形成NH3分子,中心原子N原子形成3个σ键,孤电子对数为![]() ,则N原子的价层电子对数为4,则NH3分子的空间构型为三角锥形,其中N原子的杂化轨道类型为sp3杂化,故答案为:N;N原子的2p轨道为半充满的稳定结构,较难失电子,故其第一电离能较大;三角锥形;sp3杂化;
,则N原子的价层电子对数为4,则NH3分子的空间构型为三角锥形,其中N原子的杂化轨道类型为sp3杂化,故答案为:N;N原子的2p轨道为半充满的稳定结构,较难失电子,故其第一电离能较大;三角锥形;sp3杂化;
(3)C2为N2分子,其分子结构为![]() ,故其σ键和π键数目之比是1:2;C2D为N2O,BD2为CO2,二者的价电子总数和原子总数相等,故它们互为等电子体,故答案为:1:2;等电子体;二者的价电子总数和原子总数相等;
,故其σ键和π键数目之比是1:2;C2D为N2O,BD2为CO2,二者的价电子总数和原子总数相等,故它们互为等电子体,故答案为:1:2;等电子体;二者的价电子总数和原子总数相等;
(4)BA4D为CH4O,BA2D为CH2O,在Cu的催化下,分子式为CH4O的化合物可被氧化为分子式为CH2O的化合物,则CH4O为甲醇,CH2O为甲醛,其结构式为![]() ,中心原子C原子采取sp2杂化,则CH2O分子中键角约为120。;甲醇和甲醛两化合物均易溶于水,是由于与水分子间形成了氢键的缘故,故答案为:120。;氢;
,中心原子C原子采取sp2杂化,则CH2O分子中键角约为120。;甲醇和甲醛两化合物均易溶于水,是由于与水分子间形成了氢键的缘故,故答案为:120。;氢;
(5)元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,则其面心立方堆积的晶胞中所含铜原子的个数为![]() ,体心立方堆积的晶胞中所含铜原子的个数为
,体心立方堆积的晶胞中所含铜原子的个数为![]() ,则二者实际含有的Cu原子的个数之比为1:2;C元素的该种单质晶体硬度很大,且具有如图所示的结构,则该晶体为金刚石,其为原子晶体,其熔点比Cu单质晶体的熔点高;金刚石中C原子(如图中A、B两原子)在体对角线上外切,设碳原子的半径为r,则可得
,则二者实际含有的Cu原子的个数之比为1:2;C元素的该种单质晶体硬度很大,且具有如图所示的结构,则该晶体为金刚石,其为原子晶体,其熔点比Cu单质晶体的熔点高;金刚石中C原子(如图中A、B两原子)在体对角线上外切,设碳原子的半径为r,则可得![]() ,解得
,解得![]() ,则该晶体的空间利用率约为
,则该晶体的空间利用率约为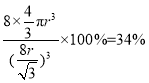 ,故答案为:2:1;高于;34%。
,故答案为:2:1;高于;34%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案