题目内容
【题目】对于可逆反应 2AB3(g)![]() A2(g) + 3B2(g) △H>0,下列图像正确的是
A2(g) + 3B2(g) △H>0,下列图像正确的是
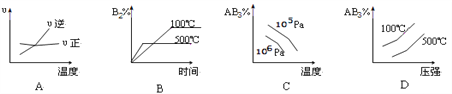
A. A B. B C. C D. D
【答案】D
【解析】该可逆反应正反应方向为气体体积增大的吸热反应,若在平衡状态下升高温度后,化学平衡会向正反应方向移动;若增大压强,化学平衡会向逆反应方向移动。A,图像中两线的交点表示正反应速率和逆反应速率相等,所以此点表示该反应处于化学平衡状态,以此点为基准,升高温度后,逆反应速率大于正反应速率,说明升高温度后化学平衡向逆反应方向移动,这与题干中反应特点不同,A不正确。B,图像表示升高温度后生成物B2的百分含量减小,说明化学平衡向逆反应方向移动,这与题干反应特点不符,B不正确。C,由图像可知,在相同温度下,压强越大,反应物AB3的百分含量减小,这与题干的反应特点不符,C不正确。D,由图像可知,在相同温度下AB3的百分含量随压强升高而增大;在相同压强下,AB3的百分含量随温度升高而减小,与题干中的反应特点相符,所以D正确。

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案【题目】将V1 mL 1.0 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后,测量并记录溶液的温度,实验结果如下图所示,实验中始终保持V1+V2=50。

(1)对于反应:HCl+NaOH= NaCl+H2O,反应物所具有的总能量E1和生成物所具有的总能量E2的关系为:E1____E2。(填“>”、“ <”或“=”)
(2)实验中所用NaOH溶液的浓度为____mol·L-1。
(3)若含有8.0 g NaOH的稀溶液与稍过量的1 L 0.21 mol·L-1的盐酸反应放出11.46 kJ的热量,则表示中和热的热化学方程式为___________________。
(4)若取50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液置于如图所示的装置中进行中和热的测定实验,回答下列问题:
①从实验装置看,其中尚缺少的一种玻璃用品是_________;
实验序号 | 起始温度t1/℃ | 终止温度 (t2)℃ | ||
盐酸 | NaOH溶液 | 平均值 | ||
1 | 25.1 | 24.9 | 25.0 | 28.0 |
2 | 25.1 | 25.1 | 25.1 | 28.2 |
3 | 25.1 | 25.1 | 25.1 | 28.3 |
4 | 25.1 | 25.1 | 25.1 | 27.4 |

已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18kJ/(kg·K),根据上表数据,求出该反应的中和热△H=____________ (保留2位小数) ;
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是_______________。
【题目】一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),部分数据见下表(表中t2>t1)
CO2(g)+H2(g),部分数据见下表(表中t2>t1)
反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
下列说法正确的是
A. 反应在t1min末的速率为v(H2)=0.40/t1 mol·L-1·min-1
B. 平衡时CO的转化率为66.67%
C. 该温度下反应的平衡常数为1
D. 其他条件不变,若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时n(CO2)=0.20mol
【题目】表是元素周期表的一部分,已知⑤为短周期元素,其单质为淡黄色固体,据表回答有关问题:
① | ② | ||||||
③ | ④ | ⑤ | ⑥ | ⑦ | |||
⑧ | ⑨ |
(1)画出元素⑧的原子结构示意图
(2)在这些元素中,最活泼的非金属元素是 , 最不活泼的元素是(写元素符号 ).
(3)在这些元素的最高价氧化物对应水化物中,碱性最强的是(写化学式),呈两性的氢氧化物是(写化学式),写出两者之间反应的离子方程式:
(4)在⑥与⑨中,化学性质较活泼的是(写元素符号 ),写出可以验证该结论的一个化学反应方式 .
