题目内容
【题目】一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),部分数据见下表(表中t2>t1)
CO2(g)+H2(g),部分数据见下表(表中t2>t1)
反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
下列说法正确的是
A. 反应在t1min末的速率为v(H2)=0.40/t1 mol·L-1·min-1
B. 平衡时CO的转化率为66.67%
C. 该温度下反应的平衡常数为1
D. 其他条件不变,若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时n(CO2)=0.20mol
【答案】C
【解析】t1min末n(CO)=0.8mol,反应消耗n(CO)=0.4mol,根据方程式生成n(CO2)=0.4mol,生成n(H2)= 0.4mol,反应在0--t1min内的平均速率为v(H2)= ![]() 0.20/t1 mol·L-1·min-1,故A错误;t1min末n(CO)=0.8mol,反应消耗n(CO)=0.4mol,消耗n(H2O)=0.4mol,t1min末n(H2O)=0.2mol,t2min末n(H2O)=0.2mol,所以可知t1min末反应达到平衡状态,平衡时CO的转化率为
0.20/t1 mol·L-1·min-1,故A错误;t1min末n(CO)=0.8mol,反应消耗n(CO)=0.4mol,消耗n(H2O)=0.4mol,t1min末n(H2O)=0.2mol,t2min末n(H2O)=0.2mol,所以可知t1min末反应达到平衡状态,平衡时CO的转化率为![]() 33.33%,故B错误;t1min末反应达到平衡状态,n(CO)=0.8mol、n(H2O)=0.2mol、n(CO2)=0.4mol、n(H2)=0.4mol,该温度下反应的平衡常数
33.33%,故B错误;t1min末反应达到平衡状态,n(CO)=0.8mol、n(H2O)=0.2mol、n(CO2)=0.4mol、n(H2)=0.4mol,该温度下反应的平衡常数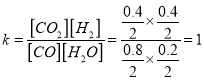 ,故C正确;若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时n(CO2)=0.40mol,故D错误。
,故C正确;若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时n(CO2)=0.40mol,故D错误。

练习册系列答案
相关题目