题目内容
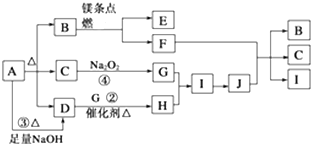
12.五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期.C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙.A原子的最外层电子数比次外层电子层多3个.D周期序数等于D原子最外层电子数.E原子半径是同周期中最小的(除稀有气体外)根据以上信息回答下列问题:(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是O<N<Cl<Al<Na(用元素符号填写),其中D的最高价氧化物是两性氧化物.
(2)乙物质中存在的化学键类型是离子键、共价键.
(3)化合物乙的电子式
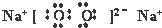 .
.(4)写出C与D的最高价氧化物对应的水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O
(5)E的单质通入C的最高价氧化物对应的水化物的溶液中反应生成的“84”消毒液的主要成分的化学式为NaClO.
分析 A、B、C、D、E都是短周期元素,原子序数逐渐增大,A原子的最外层电子数比次外层电子层多3个,原子只能有2个电子层,最外层电子数为5,故A为N元素;A、B处于同一周期,C、D、E同处另一周期,则B处于第二周期,C、D、E处于第三周期,D周期序数等于D原子最外层电子数,则D为Al,E原子半径是同周期中最小的(除稀有气体外),可知E为Cl,而C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则C是Na元素,B是O元素,甲是Na2O,乙是Na2O2,据此答题.
解答 解:A、B、C、D、E都是短周期元素,原子序数逐渐增大,A原子的最外层电子数比次外层电子层多3个,原子只能有2个电子层,最外层电子数为5,故A为N元素;A、B处于同一周期,C、D、E同处另一周期,则B处于第二周期,C、D、E处于第三周期,D周期序数等于D原子最外层电子数,则D为Al,E原子半径是同周期中最小的(除稀有气体外),可知E为Cl,而C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则C是Na元素,B是O元素,甲是Na2O,乙是Na2O2.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,电子层越多原子半径越大,故原子半径:O<N<Cl<Al<Na,故答案为:O<N<Cl<Al<Na;
(2)D的最高价氧化物为氧化铝,属于两性氧化物,故答案为:两性;
(3)乙是Na2O2,含有离子键、共价键,故答案为:离子键、共价键;
(3)乙是Na2O2,电子式为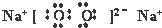 ,故答案为:
,故答案为: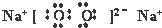 ;
;
(4)C与D的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(5)E的单质为氯气,C的最高价氧化物对应的水化物为NaOH,氯气通入氢氧化钠的溶液中反应生成的“84”消毒液的主要成分的化学式为:NaClO,故答案为:NaClO.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对基础知识的理解掌握.

①酸性:HClO4>H2SO4>H3PO4>H2SiO3
②稳定性:HF<H2O<H2S
③碱性:KOH>NaOH>Mg(OH)2
④熔沸点:Rb>K>Na>Li
⑤粒子半径:F-<Na+<Mg2+<Al3+
⑥O与S为同主族元素,且O比S的非金属性强
⑦第二周期元素从Li到F,非金属性逐渐增强
⑧在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂,砹(At)为无色固体,AgAt难溶于水也不溶于稀硝酸.
| A. | ①③⑥⑦ | B. | ②④⑤⑧ | C. | ①③⑤⑧ | D. | ④⑤⑥⑦ |
| A. | 得0.20mol NaCl和0.08mol NaHCO3 | |
| B. | 剩0.04mol Na2CO3,得0.20mol NaCl | |
| C. | 剩0.06mol HCl,得0.14mol NaCl和0.14mol NaHCO3 | |
| D. | 得0.06mol NaCl和0.08mol NaHCO3 |
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ② | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | 氯水中含有Cl- |
| ② | 将氯水滴加到含有酚酞的NaOH溶液中 | 溶液褪色 | |
| ③ | 取一小片KI淀粉试纸,置于表面皿或玻璃片上,用洁净的玻璃棒蘸取氯水,滴在试纸上 | 淀粉-KI试纸变蓝色 | 氯水中含有Cl2 |
| ④ | 将足量的氯水滴加到Na2CO3溶液中 | 出现气泡 | 氯水中含有H+ |
(2)指出实验②和实验④中的实验现象:②溶液褪色;④有气泡冒出.
(3)实验③中“实验方法”的具体操作过程是:取一小片KI淀粉试纸,置于表面皿或玻璃片上,用洁净的玻璃棒蘸取氯水,滴在试纸上.
(4)若实验中使用的是久置的氯水,实验方法不变,对上述①④实验无影响.
| A. | 甲醇(CH3OH)和乙醇互为同系物 | |
| B. | 不同元素的原子构成的分子只能含极性共价键 | |
| C. | ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U是中子数不同质子数相同的同种核素 | |
| D. | 短周期第IVA与VIIA族元素的原子间构成的分子,均不满足原子最外层8电子结构 |
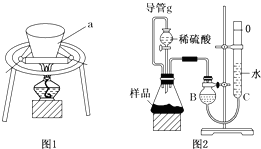 小苏打长期放置在空气中会变质(部分转变为Na2CO3),某研究小组欲测定某小苏打样品中NaHCO3的质量分数,设计如下实验方案:
小苏打长期放置在空气中会变质(部分转变为Na2CO3),某研究小组欲测定某小苏打样品中NaHCO3的质量分数,设计如下实验方案: 如图所示为中学化学实验中几种常见仪器的部分结构:
如图所示为中学化学实验中几种常见仪器的部分结构: