题目内容
2.下列说法不正确的是( )①酸性:HClO4>H2SO4>H3PO4>H2SiO3
②稳定性:HF<H2O<H2S
③碱性:KOH>NaOH>Mg(OH)2
④熔沸点:Rb>K>Na>Li
⑤粒子半径:F-<Na+<Mg2+<Al3+
⑥O与S为同主族元素,且O比S的非金属性强
⑦第二周期元素从Li到F,非金属性逐渐增强
⑧在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂,砹(At)为无色固体,AgAt难溶于水也不溶于稀硝酸.
| A. | ①③⑥⑦ | B. | ②④⑤⑧ | C. | ①③⑤⑧ | D. | ④⑤⑥⑦ |
分析 ①元素非金属性越强,其最高价氧化物的水化物酸性越强;
②元素非金属性越强,其氢化物的稳定性越强;
③元素金属性越强,其最高价氧化物的水化物碱性越强;
④碱金属族元素单质,其单质熔沸点随着原子序数增大而减小;
⑤电子层结构相同的离子,离子半径随着原子序数增大而减小;
⑥同一主族元素,元素非金属性随着原子序数增大而减弱;
⑦同一周期元素,元素非金属性随着原子序数增大而增强;
⑧卤族元素单质都是有色物质,且随着原子序数增大其单质颜色加深.
解答 解:①元素非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P>Si,所以酸性:HClO4>H2SO4>H3PO4>H2SiO3 ,故正确;
②元素非金属性越强,其氢化物的稳定性越强,非金属性F>O>S,所以稳定性HF>H2O>H2S,故错误;
③元素金属性越强,其最高价氧化物的水化物碱性越强,金属性K>Na>Mg,所以碱性:KOH>NaOH>Mg(OH)2,故正确;
④碱金属族元素单质,其单质熔沸点随着原子序数增大而减小,所以熔沸点:Rb<K<Na<Li,故错误;
⑤电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径:F->Na+>Mg2+>Al3+,故错误;
⑥同一主族元素,元素非金属性随着原子序数增大而减弱,所以O与S为同主族元素,且O比S的非金属性强,故正确;
⑦同一周期元素,元素非金属性随着原子序数增大而增强,所以第二周期元素从Li到F,非金属性逐渐增强,故正确;
⑧卤族元素单质都是有色物质,且随着原子序数增大其单质颜色加深,所以At是有色固体,故错误;
故选B.
点评 本题考查元素周期律,涉及同一周期、同一主族元素性质相似性及递变性,注意:氢化物的稳定性与化学键有关,氢化物熔沸点与分子间作用力及氢键有关,为易错点.

| 碳酸二甲酯资料 | |||||
| 简称 | 键线式 | 熔点 | 沸点 | 化学性质 | 用途 |
| DMC |  | 4℃ | 90.1℃ | 非常活泼、很易水解 毒性很低 | 有机合成中间体 |
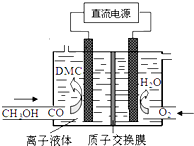 则下列说法正确的是( )
则下列说法正确的是( )| A. | 通O2区是阴极区,质子通过交换膜从阴极区移向阳极区 | |
| B. | 阳极反应:CO-2e-+2CH3OH═(CH3O)2CO+2H+ | |
| C. | 离子液体必须是水溶液,目的是传递电荷 | |
| D. | 电合成DMC的总反应方程式:CO+2CH3OH═(CH3O)2CO+H2 |
| A. | 硅原子和钠原子 | B. | 硼原子和氦原子 | C. | 氯原子和碳原子 | D. | 碳原子和铝原子 |
限选试剂:浓硫酸、1.0mol•L-1HNO3、1.0mol•L-1盐酸、1.0mol•L-1NaOH、3%H2O2、0.1mol•L-1 KI、0.1mol•L-1CuSO4、20%KSCN、澄清石灰水、氧化铜、蒸馏水.
(1)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3.通过利用焰色反应可验证固体产物中是否含有钾元素.
(2)固体产物中铁元素存在形式的探究.
①提出合理假设
假设1:全部是铁单质;
假设2:全部为FeO;
假设3:同时存在铁单质和FeO.
②设计实验方案证明你的假设
③实验过程
根据②中方案进行实验.在写出实验步骤、预期现象与结论.
| 实验步骤 | 预期现象与结论 |
| 步骤1:取适量固体产物与试管中,加入足量蒸馏水,充分振荡使碳酸钾完全溶解.分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体 | 部分固体不溶解 |
| 步骤2:向试管中加入适量硫酸铜溶液,再加入少量不溶固体,充分振荡 | (1)若蓝色溶液颜色及加入的不溶固体无明显变化,则假设2成立. (2)若蓝色溶液颜色明显改变,且有暗红色固体生成,则证明有铁单质存在 |
| 步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤至洗涤液无色,取少量固体于试管中,滴加过量HCl后,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN | 结合步骤2中的(2): (1)若溶液基本无色,则假设1成立 (2)若溶液呈血红色,则假设3成立 |
| X | Y | |
| Z | W |
| A. | ZW3为非极性分子 | B. | 原子半径:Z>X>Y | ||
| C. | W的单质是制取盐酸的原料之一 | D. | XW3中W显+1价 |
| A. | 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 酸和碱发生中和反应生成1mol水,这时的反应热叫中和热 | |
| C. | 配制AlCl3饱和溶液时,将AlCl3固体加入沸水中以加速溶解 | |
| D. | 在稀溶液中,1molCH3COOH和1mol NaOH完全中和时放出的热量小于57.3kJ |

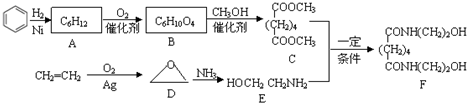
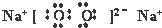 .
.