题目内容
12.在4000C,101.3k Pa时,3L某烃A在m L氧气中完全燃烧,燃烧后测得气体体积(m+6)L(气体体积均在同温同压下测定)试回答下列问题:(1)烃A的组成中应满足的条件烃A的组成应满足条件是每个分子中含8个氢原子;
(2)当m=27时,烃A可能的分子式(只要求写出三种可能的分子式).三种可能的分子式是:C3H8,C4H8,C5H8(或C6H8、C7H8);
(3)若烃A在常温常压下为气态物质时,m的取值范围m≥18.
分析 (1)依据烃燃烧的通式400℃时,生成的水为气态,根据烃燃烧通式CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,利用气体体积差量计算;
(2)根据3LA完全燃烧消耗氧气的体积判断x的范围,然后写出烃A的分子式;
(3)烃A在常温下为气态,则x≤4,然后根据3LA完全燃烧消耗氧气的量确定m的范围.
解答 解:(1)设烃的分子式为CxHy,则:
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(g) 气体体积差量△V
1 (x+$\frac{y}{2}$-x-$\frac{y}{4}$-1)=$\frac{y}{4}$-1
3L (m+6-m-3)L
解得:y=8,
即该烃的分子式为:CxH8,说明烃A的组成应满足条件是每个分子中含8个氢原子,
故答案为:烃A的组成应满足条件是每个分子中含8个氢原子;
(2)当m=27时,3L烃A完全燃烧消耗了27L氧气,则x+$\frac{8}{4}$≤$\frac{27L}{3L}$=9,即:x≤7,所以烃A的分子式可以为:C3H8、C4H8、C5H8、C6H8、C7H8,
故答案为:C3H8;C4H8;C5H8(或 C6H8、C7H8);
(3)若烃A在常温常压下为气态物质时,CxH8中的x必须满足x≤4,则:x+$\frac{8}{4}$≤$\frac{mL}{3L}$,解得:m≥3x+6,所以m≥18,
故答案为:m≥18.
点评 本题考查有机物分子式确定的计算,为高考的常见题型,属于中等难度的试题,该题的关键是根据有机物的燃烧通式,然后结合题意灵活运用即可,试题侧重对学生解题能力和方法的指导与训练,有利于培养学生的逻辑推理能力,提高学生的应试能力.

| A. | pH值减小 | B. | c(H+)和c(OH-)的乘积增大 | ||
| C. | 酸性减弱 | D. | OH-离子浓度减小 |
①氧化还原反应的实质是元素的化合价发生改变
②若1mol气体的体积为22.4L,则它一定处于标准状况下
③标准状况下,1L HCl和1L H2O的物质的量相同
④在熔融状态下可以导电的物质就是电解质
⑤利用丁达尔现象区别溶液和胶体
⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑦在同温同体积时,气体物质的物质的量越大,则压强越大
⑧同温同压下,气体的密度与气体的相对分子质量成正比.
| A. | 除③外 | B. | ④⑤⑥⑦⑧ | C. | ⑤⑦⑧ | D. | ①⑤⑦⑧ |
| A. | Ag | B. | FeI2 | C. | SO2 | D. | C |
| X | Y | Z | W | |
| 结构 或 性质 | X的最高价氧化物对应的水化物与其气态氢化物反应可得到一种盐 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,Z的离子半径最小 | 原子核外最外层电子数是次外层电子数的一半 |
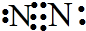 .
.(2)W元素在周期表中的位置为第三周期ⅣA族.
(3)Y的最高价氧化物对应水化物与Z单质反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(4)下列可作为比较Z和Mg金属性强弱的方法是bd(填代号).
a.比较两种元素在化合物中化合价的高低
b.相同温度下测等浓度相应氯化物水溶液的pH
c.在常温条件下比较单质与浓硝酸反应的剧烈程度
d.在两种金属氯化物的水溶液中分别滴加过量的NaOH溶液
e.比较等量的两种金属与盐酸反应放气体的多少.
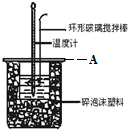 分别取40mL 的0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
分别取40mL 的0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O (l)△H=-57.3 kJ/mol;
(2)A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃棒,两个小孔不能开得过大,其原因是减少热量散失;反应需要测量温度,每次测量温度后都必须用水将温度计上的液体冲掉,并擦干温度计;
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).实验时,还需测量的数据有ACE;
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(5)假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”).
| A. | 0.01mol•L-1HCl | B. | pH=2的H2SO4溶液 | ||
| C. | c(OH)=10-13mol•L-1 | D. | pH=1溶液加水稀释1倍 |