题目内容
【题目】四种常见元素的性质或结构信息如表,根据信息回答有关问题.
元素 | A | B | C | D |
性质 | 原子核外有两个电子层,最外层有3个未成对电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为:[Ar]3 d104sx , 有+1、+2两种常见化合价 | 有两种常见氧化物,其中一种是冶炼金属工业的常用还原剂 |
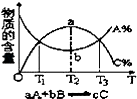
(1)A元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为(用元素符号表示);试解释原因 .
(2)B元素的低价氧化物分子中心原子的杂化方式为 , B元素的最高价氧化物分子的VSEPR构型为;B元素与D元素形成分子空间构型为;
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点(填“高”或“低”),其原因是;
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为;后一现象的离子方程式为: .
(5)C晶体的堆积方式如图所示 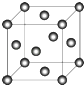 ,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为 , C晶体的密度为gcm﹣3(要求写表达式,可以不简化).
,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为 , C晶体的密度为gcm﹣3(要求写表达式,可以不简化).
【答案】
(1)N>O>C;同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,第一电离能高于同周期相邻元素的
(2)sp2杂化;平面三角形;直线形
(3)低;CO2是分子晶体,SiO2是原子晶体
(4)先生成蓝色沉淀,后沉淀溶解,最后得到深蓝色溶液;Cu(OH)2+4NH3?H2O═[Cu(NH3)4]2++4H2O+2OH﹣
(5)12;![]()
【解析】解:A原子核外有两个电子层,最外层有3个未成对的电子,外围电子排布为2s22p3 , 故A为N元素;B原子的M层有1对成对的p电子,外围电子排布为3s23p4 , 故B为S元素;C原子的核外电子排布为[Ar]3d104sx , 有+1、+2两种常见化合价,故C为Cu元素;D有两种常见氧化物,其中有一种是冶金工业常用的还原剂,故D为C元素.(1)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能:N>O>C,所以答案是:N>O>C;同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,第一电离能高于同周期相邻元素的;(2)B元素的低价氧化物分子为SO2 , S原子孤电子对数为 ![]() =1、价层电子对数=2+1=3,杂化轨道数目为3,故S原子采取sp2杂化,B元素的最高价氧化物为SO3 , 分子中S原子价层电子对数为3+
=1、价层电子对数=2+1=3,杂化轨道数目为3,故S原子采取sp2杂化,B元素的最高价氧化物为SO3 , 分子中S原子价层电子对数为3+ ![]() =3,其的VSEPR构型为平面三角形,B元素与D元素形成分子为CO、CO2 , 空间构型为,直线形,所以答案是:sp2杂化;平面三角形;直线形;(3)D元素最高价氧化物为二氧化碳,同主族相邻元素最高价氧化物为二氧化硅,CO2是分子晶体,SiO2是原子晶体,则二氧化碳的熔点比二氧化硅的低,所以答案是:低;CO2是分子晶体,SiO2是原子晶体;(4)C元素的硫酸盐为硫酸铜,硫酸铜溶液中逐滴加入过量氨水溶液,先生成氢氧化铜沉淀,后氢氧化铜溶解得到四氨合铜络离子,观察到的现象为:先生成蓝色沉淀,后沉淀溶解,最后得到深蓝色溶液,后一现象的离子方程式为:Cu(OH)2+4NH3H2O═[Cu(NH3)4]2++4H2O+2OH﹣ , 所以答案是:先生成蓝色沉淀,后沉淀溶解,最后得到深蓝色溶液;Cu(OH)2+4NH3H2O═[Cu(NH3)4]2++4H2O+2OH﹣;(5)Cu晶体为面心立方密堆积,以顶点Cu原子研究,与之相邻的Cu原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,则Cu原子配位数为
=3,其的VSEPR构型为平面三角形,B元素与D元素形成分子为CO、CO2 , 空间构型为,直线形,所以答案是:sp2杂化;平面三角形;直线形;(3)D元素最高价氧化物为二氧化碳,同主族相邻元素最高价氧化物为二氧化硅,CO2是分子晶体,SiO2是原子晶体,则二氧化碳的熔点比二氧化硅的低,所以答案是:低;CO2是分子晶体,SiO2是原子晶体;(4)C元素的硫酸盐为硫酸铜,硫酸铜溶液中逐滴加入过量氨水溶液,先生成氢氧化铜沉淀,后氢氧化铜溶解得到四氨合铜络离子,观察到的现象为:先生成蓝色沉淀,后沉淀溶解,最后得到深蓝色溶液,后一现象的离子方程式为:Cu(OH)2+4NH3H2O═[Cu(NH3)4]2++4H2O+2OH﹣ , 所以答案是:先生成蓝色沉淀,后沉淀溶解,最后得到深蓝色溶液;Cu(OH)2+4NH3H2O═[Cu(NH3)4]2++4H2O+2OH﹣;(5)Cu晶体为面心立方密堆积,以顶点Cu原子研究,与之相邻的Cu原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,则Cu原子配位数为 ![]() =12,晶胞中Cu原子数目为8×
=12,晶胞中Cu原子数目为8× ![]() +6×
+6× ![]() =4,则晶胞质量为4×
=4,则晶胞质量为4× ![]() g,则晶胞密度为4×
g,则晶胞密度为4× ![]() g÷(a cm)3=
g÷(a cm)3= ![]() gcm﹣3 ,
gcm﹣3 ,
所以答案是:12; ![]() .
.

 备战中考寒假系列答案
备战中考寒假系列答案【题目】四种常见元素的性质或结构信息如表,根据信息回答有关问题.
元素 | A | B | C | D |
性质 | 原子核外有两个电子层,最外层有3个未成对电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为:[Ar]3 d104sx , 有+1、+2两种常见化合价 | 有两种常见氧化物,其中一种是冶炼金属工业的常用还原剂 |
(1)A元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为(用元素符号表示);试解释原因 .
(2)B元素的低价氧化物分子中心原子的杂化方式为 , B元素的最高价氧化物分子的VSEPR构型为;B元素与D元素形成分子空间构型为;
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点(填“高”或“低”),其原因是;
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为;后一现象的离子方程式为: .
(5)C晶体的堆积方式如图所示 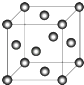 ,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为 , C晶体的密度为gcm﹣3(要求写表达式,可以不简化).
,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为 , C晶体的密度为gcm﹣3(要求写表达式,可以不简化).
【题目】化学课外活动小组利用以下装置完成系列实验.请回答以下问题: 
(1)装置甲中仪器a的名称为 . 用装置甲制取NH3 , 在b中加入CaO固体,a中加入浓氨水,写出反应的化学方程式: .
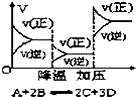
(2)将C12持续通入装有淀粉一KI无色溶液的装置乙中,溶液变蓝而后逐渐褪色.查阅资料得知:溶液蓝色逐渐褪色,是因为有+5价的碘元素生成.请写出该反应的离子方程式: .
(3)用装置丙模拟“氨的催化氧化”实验.锥形瓶内装有浓氨水,通入空气,并将红热的铂丝插入锥形瓶内,铂丝保持红热.铂丝保持红热的原因是;锥形瓶内还可观察到现象是 .
(4)活动小组从“绿色化学”角度出发.在装置丁中进 行SO2的性质实验.其中棉花上蘸有不同试剂.请填写表中空白:
棉花位置 | ① | ② | ③ |
棉花上蘸有的试剂 | 品红溶液 | 酸性高锰酸钾溶液 | |
现象 | 溶液紫色褪去 | 无 | |
结论 | SO2具有漂白性 | SO2具有 | SO2有毒,不能排空 |