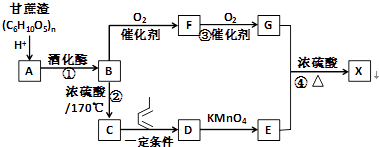
��Ŀ����
����Ŀ�������йص������Һ��˵����ȷ���ǣ� ��
A.��CH3COOH��Һ������ʵ�飬���ݺܰ���֤��CH3COOH���������
B.pH��ͬ�Ĵ�������ᣬȡ���������������Һ�ֱ�ϡ����ԭ��Һ�����m����n����ϡ�ͺ�����Һ��pH��Ȼ��ͬ����m��n
C.�����£���0.10 molL��1��NH3H2O��Һ�м�������NH4Cl���壬��ʹ��Һ��pH��С��c��NH4+��/c��NH3H2O����ֵ����
D.�����£�CH3COOH��Ka=1.7��10��5 �� NH3H2O��Kb=1.7��10��5 �� CH3COOH��Һ�е�c��H+����NH3H2O����Һ�е�c��OH�������
���𰸡�C
���������⣺A����CH3COOH��Һ������ʵ�飬���ݺܰ���˵����Һ������Ũ�Ƚϵͣ�������˵�����Ჿ�ֵ��룬���Բ���˵�����������ᣬ��A����
B��pH��ͬ�������ͬ�Ĵ��������������Һ�ֱ��ˮϡ�ͺٽ�����ĵ��룬Ҫʹ����Һ��pH��Ȼ��ͬ������ϡ�͵ı�����m��n����B����
C����0.10 molL��1��NH3H2O��Һ�м�������NH4Cl���壬ƽ�������ƶ������������ӵ�Ũ�ȼ�С����Һ�ļ��Լ����������������ӵ�Ũ�ȼ��٣����¶Ȳ��䣬����ƽ�ⳣ�����䣬�� ![]() =
= ![]() ������
������ ![]() ���C��ȷ��
���C��ȷ��
D�������£�������Һ��c��H+��= ![]() ����ˮ��Һ��c��OH����=
����ˮ��Һ��c��OH����= ![]() ��������Һ��Ũ����Դ�Сδ֪���������жϴ�����Һ��������Ũ�ȺͰ�ˮ������������Ũ�ȵ���Դ�С����D����
��������Һ��Ũ����Դ�Сδ֪���������жϴ�����Һ��������Ũ�ȺͰ�ˮ������������Ũ�ȵ���Դ�С����D����
��ѡC��
�����㾫����������Ĺؼ������������������ˮ��Һ�еĵ���ƽ������֪ʶ�����յ�������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ����