题目内容
13.下列叙述中不正确的是 ( )| A. | 卤素单质的颜色按Cl2、Br2、I2的顺序逐渐变深 | |
| B. | Cl2、Br2、I2的氧化性逐渐增强 | |
| C. | 氯、溴、碘的原子半径或离子半径随电子层数的增多而增大 | |
| D. | 氯气易液化,溴单质易挥发,碘单质易升华 |
分析 元素周期表中,同主族元素从上到下元素的非金属性逐渐减弱,单质的氧化性逐渐减弱,原子半径逐渐增大,卤素单质Cl2、Br2、I2的颜色分别为黄绿色、红棕色、紫色,其中氯气易液化,溴单质易挥发,碘单质易升华,以此解答该题.
解答 解:A.卤素单质Cl2、Br2、I2的颜色分别为黄绿色、红棕色、紫色,逐渐加深,故A正确;
B.同主族元素从上到下元素的非金属性逐渐减弱,单质的氧化性逐渐减弱,故B错误;
C.同主族元素从上到下原子、离子半径逐渐增大,则氯、溴、碘的原子半径或离子半径随电子层数的增多而增大,故C正确;
D.氯气常温下为气体,易液化,溴单质常温下为液体,易挥发,碘单质为固体,熔点与沸点相接近,易升华,故D正确.
故选B.
点评 本题考查了卤素单质氧化性、密度、颜色、氢化物的性质,明确元素周期律是解本题关键,根据元素周期律来分析解答即可,熟记元素周期律内涵,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.在含有AlO2-的溶液中,下列离子可以大量共存的是( )
| A. | CO32-、OH-、Cl-、NH4+ | B. | Na+、K+、HSO3-、Cl-. | ||
| C. | K+、Na+、S2-、NO3-. | D. | Na+、Al3+、Cl-、K+ |
1.填写下表:
| 物质的质量/g | 物质的量/mol | 微 粒/个 |
| 280g 铁原子 | 5 | 5NA |
| 3.4g氢氧根离子 | 0.2 | 0.2NA |
| 196 | 2mol硫酸分子 | 2NA |
| 19.2 | 0.8mol镁原子 | 0.8NA |
| 16 | 0.5 | 3.01×1023个氧分子 |
| 180 | 10 | 6.02×1024个铵根离子 |
18.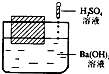 如图所示,在一只盛有Ba(OH)2溶液的烧杯中,漂浮着一个小木块,若小心地向烧杯中滴加与 Ba(OH)2溶液密度相同的稀硫酸,静止片刻后,小木块浸入液体中的体积与原先相比( )
如图所示,在一只盛有Ba(OH)2溶液的烧杯中,漂浮着一个小木块,若小心地向烧杯中滴加与 Ba(OH)2溶液密度相同的稀硫酸,静止片刻后,小木块浸入液体中的体积与原先相比( )
 如图所示,在一只盛有Ba(OH)2溶液的烧杯中,漂浮着一个小木块,若小心地向烧杯中滴加与 Ba(OH)2溶液密度相同的稀硫酸,静止片刻后,小木块浸入液体中的体积与原先相比( )
如图所示,在一只盛有Ba(OH)2溶液的烧杯中,漂浮着一个小木块,若小心地向烧杯中滴加与 Ba(OH)2溶液密度相同的稀硫酸,静止片刻后,小木块浸入液体中的体积与原先相比( )| A. | 增大 | B. | 不变 | C. | 减小 | D. | 无法判断 |
2.有关新制氯水与久置在密闭容器中的饱和氯水的说法,错误的是( )
| A. | 新制氯水的酸性强 | B. | 新制氯水的酸性弱 | ||
| C. | 久置氯水中无氯分子 | D. | 久置氯水已无漂白性 |