题目内容
4.利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.已知:N2(g)+02(g)=2N0(g)△H=+180.5 kJ•mol-1
N2 (g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+02(g)=2H20(g)△H=-483.6 kJ•mol-1
若有17 g氨气经催化氧化完全反应生成一氧化氮气体和水蒸气,所放出的热量为226.3kJ.
分析 根据盖斯定律构建目标反应方程式:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol,
②N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,
由盖斯定律①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g),反应放出的热量与物质的量成正比,据此求目标方程式的反应焓变,17g氨气即1mol,根据目标方程式求经催化氧化完全反应生成一氧化氮气体和水蒸气,所放出的热量.
解答 解:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol,
②N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,
由盖斯定律①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=(+180.5kJ/mol)×2-(-92.4kJ/mol)×2+(-483.6kJ/mol)×3=-905.2kJ/mol;
则17g氨气即1mol氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为$\frac{1}{4}$×905.2kJ=226.3kJ,
故答案为:226.3.
点评 本题考查反应热的计算,注意把握盖斯定律的应用是解答关键,题目难度不大.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
14.锌与100mL 18.5mol•L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液的氢离子浓度为0.1mol/L,下列叙述不正确的是( )
| A. | 反应中共转移3 mol电子 | B. | 反应中共消耗1.8 mol H2SO4 | ||
| C. | 反应中共消耗97.5 g Zn | D. | 气体甲中SO2与H2的体积比为4:1 |
12.关于如图各实验装置的叙述中,不正确的是( )

| A. | 利用图1装置可用于实验室制取少量NH3或O2 | |
| B. | 用图2可证明Cl2的氧化性强于S | |
| C. | 用图3所示装置可分离CH3CH2OH和CH3COOC2H5混合液 | |
| D. | 用图4所示装置可制取乙烯并验证其易被氧化 |
19.在含有AlO2-的溶液中,下列离子可以大量共存的是( )
| A. | CO32-、OH-、Cl-、NH4+ | B. | Na+、K+、HSO3-、Cl-. | ||
| C. | K+、Na+、S2-、NO3-. | D. | Na+、Al3+、Cl-、K+ |
9.下列有关电子云和原子轨道的说法正确的是( )
| A. | 电子云图中,小点密集表示该处的电子多 | |
| B. | 原子轨道表示原子核外电子运动的轨迹 | |
| C. | 3p轨道和2p轨道都呈纺锤形,3p轨道比2p轨道数目多 | |
| D. | 多电子原子中电子离核的平均距离4s>3s>2s |
17.根据下列有关实验得出的结论一定正确的是( )
| 选项 | 方法 | 结论 |
| A | 同温时,等质量的锌粒分别与足量稀硫酸反应 | 产生氢气量:加过胆矾=没加胆矾 |
| B | 向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液,则溶液变黄 | 氧化性:H2O2>Fe3+ |
| C | 相同温度下,等质量的大理石与等体积、等浓度的盐酸反应 | 反应速率:粉状大理石>块状大理石 |
| D | 向2mL 0.1mol•L-1Na2S溶液中滴入几滴0.1mol•L-1ZnSO4溶液,有白色沉淀生成;再加入几滴0.1mol•L-1 CuSO4溶液,则又有黑色沉淀生成 | 溶度积(Ksp):ZnS>CuS |
| A. | A | B. | B | C. | C | D. | D |

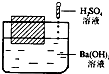 如图所示,在一只盛有Ba(OH)2溶液的烧杯中,漂浮着一个小木块,若小心地向烧杯中滴加与 Ba(OH)2溶液密度相同的稀硫酸,静止片刻后,小木块浸入液体中的体积与原先相比( )
如图所示,在一只盛有Ba(OH)2溶液的烧杯中,漂浮着一个小木块,若小心地向烧杯中滴加与 Ba(OH)2溶液密度相同的稀硫酸,静止片刻后,小木块浸入液体中的体积与原先相比( )