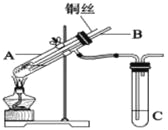
ЬтФПФкШн
ЁОЬтФПЁПСЌЖўбЧСђЫсФЦ(Na2S2O4)ЫзГЦБЃЯеЗлЃЌЪЧвЛжжЧПЛЙдМСЃЌЙуЗКгУгкЗФжЏЙЄвЕЁЃ
ЃЈ1ЃЉдквЛЖЈЮТЖШЯТЃЌНЋзуСПSO2ЦјЬхЭЈШыМзЫс(HCOOH)КЭNaOHЛьКЯШмвКжаЃЌМДгаБЃЯеЗлЩњГЩЭЌЪБЩњГЩвЛжжЦјЬхЁЃИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_________________________ЁЃ
ЃЈ2ЃЉБЃЯеЗлПЩгУгкГ§ШЅЗЯЫЎжаЕФжиИѕЫсИљРызг(Cr2O72ЉБЛзЊЛЏЮЊCr3+)ЃЌетЪЧФПЧАГ§ШЅЫсадЗЯЫЎжаИѕРызгЕФгааЇЗНЗЈжЎвЛЃЌдђУПЯћКФ0.2molБЃЯеЗлЃЌРэТлЩЯПЩГ§ШЅCr2O72ЉЕФЮяжЪЕФСПЮЊ__________mol
ЃЈ3ЃЉNa2S2O4ШмвКдкПеЦјжавзБЛбѕЛЏЃЌФГПЮЬтаЁзщВтЖЈ0.050molЁЄLЉ1Na2S2O4ШмвКдкПеЦјpHБфЛЏШчЯТЭМ1ЃЛ
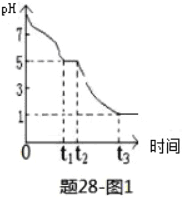

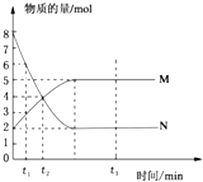
Ђй0-t1ЖЮжївЊЩњГЩHSO3ЉЃЌИљОнpHБфЛЏЭМЃЌЭЦВт0-t1ЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ_______________ЃЛ
Ђкt3ЪБШмвКжажївЊвѕРызгЪЧ_________ЃЌt2-t3НзЖЮpHБфаЁЕФжївЊдвђЪЧ______________________ЁЃ
ЂлШєt1ЪБШмвКжаNa2S2O4ШЋВПБЛбѕЛЏГЩNaHSO3ЃЌДЫЪБШмвКжаc(SO32Љ)ЁЊc(H2SO3)=___molЁЄLЉ1(ЬюзМШЗжЕЃЌВЛПМТЧШмвКЬхЛ§БфЛЏ)ЁЃ
ЃЈ4ЃЉРћгУЭМ2ЫљЪОзАжУ(ЕчМЋОљЮЊЖшадЕчМЋ)вВПЩЪЙNaHSO3зЊЛЏЮЊNa2S2O4ЃЌВЂЛёЕУНЯХЈЕФСђЫсЁЃ
ЂйaЮЊЕчдДЕФ________(ЬюЁАе§МЋЁБЛђЁАИКМЋЁБ)ЃЛ
ЂквѕМЋЕФЕчМЋЗДгІЪНЮЊ_____________________ЁЃ
ЁОД№АИЁПЃЈ1ЃЉNaOH+HCOONa+2SO2=Na2S2O4+CO2+H2OЃЛЃЈ2ЃЉ0.2ЃЛЃЈ3ЃЉЂй2S2O42-+O2+2H2O=4HSO3-ЃЛЂкSO42-ЛђHSO4-ЃЛHSO3-БЛПеЦјжаЕФбѕЦјбѕЛЏЩњГЩСђЫсЃЌШмвКжаЧтРызгХЈЖШдіДѓЃЛЃЈ4ЃЉЂйе§МЋЃЛЂк2HSO3-+2H++2e- = S2O42-+2H2OЁЃ
ЁОНтЮіЁП
ЪдЬтЗжЮіЃКЃЈ1ЃЉSO2ЦјЬхЭЈШыМзЫсФЦЕФМюадШмвКПЩвдЩњГЩNa2S2O4ЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊNaOH + HCOONa +2SO2 = Na2S2O4 + CO2 + H2OЃЛ
ЃЈ2ЃЉИљОнЕчзгЕУЪЇЪиКуПЩжЊЃЌБЃЯеЗлгыжиИѕЫсИљРызгЗДгІЕФЙиЯЕЪНЮЊCr2O72-ЁЋNa2S2O4ЃЌЫљвдУПЯћКФ0.2molБЃЯеЗлЃЌРэТлЩЯПЩвдГ§ШЅCr2O72-ЕФЮяжЪЕФСПЮЊ0.2molЃЌЙЪД№АИЮЊЃК0.2ЃЛ
ЃЈ3ЃЉЂй0ЁЋt1ЖЮжївЊЯШЩњГЩHSO3-ЃЌШмвКЯдЫсадЃЌЫЕУїHSO3-ЕФЕчРыГЬЖШДѓгкЫЎНтГЬЖШЃЛNa2S2O4ШмвКдкПеЦјжавзБЛбѕЛЏЩњГЩбЧСђЫсЧтФЦЃЌ0ЁЋt1 ЗЂЩњРызгЗДгІЗНГЬЪНЮЊЃК2S2O42-+O2+2H2O=4HSO3-ЃЌЙЪД№АИЮЊЃК2+O2+2H2O=4HSO3-ЃЛ
Ђкt3ЪБШмвКЕФpH=1ЃЌЫЕУїШмвКЕФЫсадНЯЧПЃЌвђДЫбЧСђЫсЧтФЦБЛбѕЛЏЮЊСђЫсЧтФЦЃЌдђШмвКжажївЊвѕРызгЗћКХЪЧSO42-ЛђHSO4-ЃЌt2-t3НзЖЮpHБфаЁЃЌжївЊЪЧвђЮЊHSO3-БЛПеЦјжаЕФбѕЦјбѕЛЏЩњГЩСђЫсЃЌШмвКжаЧтРызгХЈЖШдіДѓЃЌpHМѕаЁЃЌЙЪД№АИЮЊЃКSO42-ЛђHSO4-ЃЛHSO3-БЛПеЦјжаЕФбѕЦјбѕЛЏЩњГЩСђЫсЃЌШмвКжаЧтРызгХЈЖШдіДѓЃЛ
ЃЈ4ЃЉ ЂйгыЕчдДaЕчМЋЯрСЌЕФЕчМЋЩЯЖўбѕЛЏСђБЛбѕЛЏЮЊСђЫсЃЌЗЂЩњбѕЛЏЗДгІЃЌИУЕчМЋЮЊЕчНтГиЕФбєМЋЃЌЙЪaЮЊЕчдДЕФе§МЋЃЌЙЪД№АИЮЊЃКе§МЋЃЛЂквѕМЋЩЯЗЂЩњЛЙдЗДгІЃЌбЧСђЫсЧтФЦБЛЛЙдЮЊNa2S2O4ЃЌЕчМЋЗДгІЪНЮЊ2HSO3-+2H++2e- = S2O42-+2H2OЃЌ ЙЪД№АИЮЊЃК2HSO3-+2H++2e- = S2O42-+2H2OЁЃ