题目内容
【题目】绿色电源“二甲醚【(CH3)2O】﹣氧气燃料电池”的工作原理如图所示,下列说法正确的是( ) 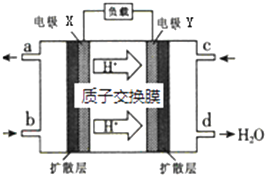
A.氧气应从c处通入,电极Y上发生的反应为:O2+4e﹣+2H2O═4OH﹣
B.电池在放电过程中,电极X周围溶液的pH增大
C.当该电池向外电路提供2 mol电子时消耗O2约为11.2L
D.二甲醚应从b处加入,电极X上发生的反应为:(CH3)2O﹣12e﹣+3H2O═2CO2+12H+
【答案】D
【解析】解:根据氢离子移动方向知,Y为原电池正极,X为负极,则c处通入的气体是氧气,根据d处生成物知,正极上发生的反应为O2+4e﹣+4H+═2H2O,电解质溶液为酸性溶液,b处通入的物质是二甲醚,X电极反应式为(CH3)2O﹣12e﹣+3H2O=2CO2+12H+ , 则a处出来的物质是二氧化碳,
A.氧气应从c处通入,电极Y上发生的反应为O2+4e﹣+4H+═2H2O,故A错误;
B.电池在放电过程中,电极X发生的电极反应为(CH3)2O﹣12e﹣+3H2O=2CO2+12H+ , X电极周围溶液的pH减小,故B错误;
C.当该电池向外电路提供2mol电子时消耗O2体积= ![]() ×22.4mol/L=11.2L,但是没有说明是在标准状况下,所以无法计算体积,故C错误;
×22.4mol/L=11.2L,但是没有说明是在标准状况下,所以无法计算体积,故C错误;
D.二甲醚应从b处加入,X电极上二甲醚得电子发生还原反应,所以电极X上发生的反应为(CH3)2O﹣12e﹣+3H2O=2CO2+12H+ , 故D正确;
故选D.

练习册系列答案
相关题目