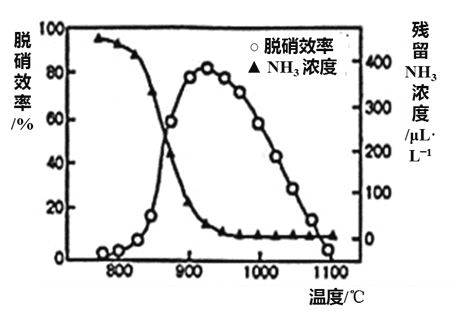
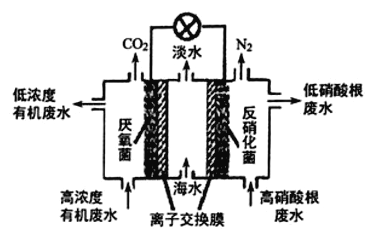
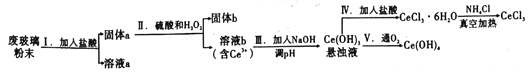
题目内容
【题目】下列各个反应,不能用于工业生产的是
A. 二氧化锰和浓盐酸共热制氯气 B. 煅烧黄铁矿(FeS2)制SO2
C. 氯气与石灰乳反应制漂白粉 D. 电解熔融氯化镁制金属镁
【答案】A
【解析】
A、工业上用电解饱和食盐水的方法制取氯气、氢氧化钠,用浓盐酸与二氧化锰共热制氯气,成本高,选项A选;B、黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其步骤为:第一步,煅烧FeS2产物为SO2和Fe3O4;第二步,SO2向SO3的转化;第三步,SO3转化为硫酸,选项B不选;C、漂白粉的有效成分是次氯酸钙,氯气和石灰乳反应生成次氯酸钙、氯化钙,石灰乳较廉价,所以适用于工业生产,选项C不选;D、工业上用电解氯化镁的方法生产金属镁,反应的化学方程式为:MgCl2![]() Mg+Cl2↑,选项D不选。答案选A。
Mg+Cl2↑,选项D不选。答案选A。

练习册系列答案
相关题目