题目内容
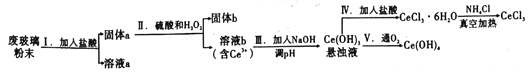
【题目】铈是地壳中含量最高的稀土元素,二氧化铈(CeO2)是其重要的化合物。平板液晶显示屏生产过程中产生大量的废玻璃粉末,其中含CeO2、SiO2、Fe2O3等物质,某实验小组以此粉末为原料回收铈,设计流程如图所示:
(1)步骤Ⅰ加入过量盐酸后,溶液a中的阳有离子___________________。
(2)步骤Ⅱ中反应的氧化剂和还原剂的物质的量之为___________。
(3)为了使步骤Ⅲ所得悬浊液中的Ce3+浓度为1×10-6mol·L-1,则加入NaOH调节溶液的pH应为____________[已知:Ce(OH)3的Ksp=8.0×10-21,lg2=0.3]。
(4)将NH4Cl固体与CeCl3·6H2O混合真空加热可得无水CeCl3,其中加入NH4Cl的作用是__________。
(5)第Ⅴ步反应的化学方程式是____________________;用反应得到的悬浊液制备纯净的Ce(OH)4需进行的实验操作为______________。
(6)对CeCl3样品纯度进行测定的方法:准确称取样品wg配成100mL溶液,取25.00mL置于锥形瓶中,加入稍过量的过二硫酸铵[(NH4)2S2O8]溶液将Ce3+氧化为Ce4+,然后用萃取剂[用(HT2)表示]萃取Ce4+,再用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(其离子反应方程式为Ce4++Fe2+=Ce3++Fe3+),重复2~3次,平均消耗VmL标准溶液。
①“萃取”时存在反应:Ce4++n(HT)2![]() Ce(H2n-4)+4H+,若要提高滴定的准确率,应使溶液呈______性(填“酸”“中”或“碱”)。
Ce(H2n-4)+4H+,若要提高滴定的准确率,应使溶液呈______性(填“酸”“中”或“碱”)。
②经计算,CeCl3样品的纯度为________________。 [M(CeCl3)=246.5g·mol-1]
【答案】 Fe3+、H+ 2:1 9.3 NH4Cl固体受热分解生成的HCl可抑制CeCl3水解 4Ce(OH)3+O2+2H2O=4Ce(OH)4 过滤、洗涤、干燥 酸 ![]() 或
或![]() (其他合理答案均可给分)
(其他合理答案均可给分)
【解析】平板液晶显示屏生产过程中产生大量的废玻璃粉末,其中含CeO2、SiO2、Fe2O3等物质,加入HCl过滤得到固体a和溶液a,溶液a中主要是氯化铁溶液和盐酸溶液,固体a中为二氧化硅和二氧化铈,固体中加入稀硫酸和过氧化氢反应后过滤得到固体b为二氧化硅,溶液b为硫酸铈溶液,加入氢氧化钠溶液调节溶液PH生成氢氧化铈沉淀,悬浊液中通氧气过滤、洗涤、干燥得到Ce(OH)4,悬浊液中加入盐酸得到CeCl3溶液,蒸发浓缩、冷却结晶、过滤洗涤得到结晶水合物,将NH4Cl固体与CeCl3·6H2O混合真空加热可得无水CeCl3,利用氯化铵分解生成的氯化氢抑制Ce3+离子的水解,得到无水CeCl3。
(1)废玻璃粉末,其中含CeO2、SiO2、Fe2O3等物质,步骤Ⅰ加入过量盐酸后,溶液a中的阳离子有Fe3+、H+,CeO2、SiO2不溶于盐酸,加入稀硫酸和过氧化氢反应后过滤得到固体b的成分是 SiO2,(2)步骤Ⅱ中反应二氧化铈在稀硫酸溶液中被过氧化氢还原生成三价铈离子,过氧化氢被氧化生成氧气,反应的离子方程式为:2CeO2+H2O2+6H+═2Ce3++O2↑+4H2O,氧化剂CeO2和还原剂的H2O2物质的量之比为2:1;(3)当溶液中离子浓度小于1×10-6mol·L-1时视为沉淀充全,结合溶度积常数计算氢氧根离子浓度c(OH-)=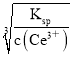 =
=![]() 2×10-5mol·L-1,c(H+)=10-14/2×10-5=5×10-10mol·L-1,得到溶液PH=-lg5×10-10=9.3;(4)将NH4Cl固体与CeCl3·6H2O混合真空加热可得无水CeCl3,其中加入NH4Cl的作用是NH4Cl固体受热分解生成的HCl可抑制CeCl3水解;(5)第V步反应是氢氧化铈被氧气氧化生成Ce(OH)4,4Ce(OH)3+O2+2H2O=4Ce(OH)4;用反应得到的悬浊液制备纯净的Ce(OH)4需进行的实验操作为过滤、洗涤、干燥;(6)①“萃取”时存在反应:Ce4++n(HT)2
2×10-5mol·L-1,c(H+)=10-14/2×10-5=5×10-10mol·L-1,得到溶液PH=-lg5×10-10=9.3;(4)将NH4Cl固体与CeCl3·6H2O混合真空加热可得无水CeCl3,其中加入NH4Cl的作用是NH4Cl固体受热分解生成的HCl可抑制CeCl3水解;(5)第V步反应是氢氧化铈被氧气氧化生成Ce(OH)4,4Ce(OH)3+O2+2H2O=4Ce(OH)4;用反应得到的悬浊液制备纯净的Ce(OH)4需进行的实验操作为过滤、洗涤、干燥;(6)①“萃取”时存在反应:Ce4++n(HT)2![]() Ce(H2n-4)+4H+,若要提高滴定的准确率,需要平衡逆向进行,因此溶液呈酸性;②电子守恒可知Ce3+物质的量等于亚铁离子的物质的量,则CeCl3样品的纯度=
Ce(H2n-4)+4H+,若要提高滴定的准确率,需要平衡逆向进行,因此溶液呈酸性;②电子守恒可知Ce3+物质的量等于亚铁离子的物质的量,则CeCl3样品的纯度= 即为
即为 ![]() 或
或![]() (其他合理答案均可给分)。
(其他合理答案均可给分)。