题目内容
【题目】前两年华北地区频繁出现的雾霾天气引起了人们的高度重视,化学反应原理可用于治理环境污染,请回答以下问题。
(1)一定条件下,可用CO处理燃煤烟气生成液态硫,实现硫的回收。
①已知:2CO(g) + O2(g) = 2CO2(g) ΔH = 566 kJ·mol1
S(l) + O2(g) = SO2(g) ΔH = 296 kJ·mol1
则用CO处理燃煤烟气的热化学方程式是________________________。
②在一定温度下,向2 L 密闭容器中充入 2 mol CO、1 mol SO2发生上述反应,达到化学平衡时SO2的转化率为90%,则该温度下该反应的平衡常数K = _________________。
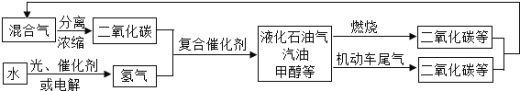
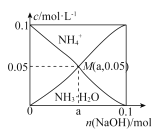
(2)SNCR─SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),其流程如下:

已知该方法中主要反应的热化学方程式:
4NH3(g) + 4NO(g) + O2(g) 4N2(g) + 6H2O(g) ΔH = 1646 kJ·mol1,在一定温度下的密闭恒压的容器中,能表示上述反应达到化学平衡状态的是__________________(填字母)。
a.4υ逆(N2) = υ正(O2)
b.混合气体的密度保持不变
c.c(N2):c(H2O):c(NH3)=4:6:4
d.单位时间内断裂4 mol N─H键的同时断裂4 mol N≡N键
(3)如图所示,反应温度会直接影响SNCR技术的脱硝效率。

①SNCR技术脱硝的温度选择925 ℃的理由是___________________。
②SNCR与SCR技术相比,SNCR技术的反应温度较高,其原因是____________________________________;但当烟气温度高于1000℃时,SNCR脱硝效率明显降低,其原因可能是_____________________。
(4)一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示:

①中间室的Cl 移向_________(填“左室”或“右室”),处理后的含硝酸根废水的pH__________(填“增大”或“减小”)
②若图中有机废水中的有机物用C6H12O6表示,请写出左室发生反应的电极反应式:______________________________________________。
【答案】 2CO(g) + SO2(g) = 2CO2(g) + S(l) ΔH = 270 kJ/mol K=1620 b 925℃时脱硝效率高,残留氨浓度较小 没有使用催化剂,反应的活化能较高 因为脱硝的主要反应是放热反应,温度过高,使脱硝反应逆向移动(或高温下N2与O2生成了NO等合理答案) 左室 增大 C6H12O6 – 24e + 6H2O = 6CO2↑ + 24H+
【解析】(1)①根据盖斯定律:第一个反应减去第二个反应整理得出CO处理燃煤烟气的热化学方程式2CO(g) + SO2(g) = 2CO2(g) + S(l) ΔH = 270 kJ/mol;正确答案:2CO(g) + SO2(g)= 2CO2(g)+ S(l) ΔH = 270 kJ/mol。
②根据已知可知:反应开始时c(CO)=1 mol/L,c(SO2)=0.5 mol/L;据反应方程式列式:
2CO(g) + SO2(g) = 2CO2(g) + S(l)
起始浓度 1 0.5 0
变化浓度 1×90% 0.5×90% 1×90%
平衡浓度 0.1 0.05 0.9
该温度下该反应的平衡常数K = c2(CO2)/ c2(CO)×c(SO2)= 0.92/ 0.12×0.05=1620;正确答案1620。
(2)速率之比和系数成正比:υ逆(N2) = 4υ正(O2),a错误;反应前后气体的总质量不变,当容器内的压强保持不变时,容器的体积也就不再发生改变,气体的密度也就不再发生变化,反应达到平衡状态;b正确;c(N2):c(H2O):c(NH3)=4:6:4 的状态仅仅是反应进行过程中一种状态,无法判定平衡状态; c错误;单位时间内断裂12mol N─H键的同时断裂4 mol N≡N键,反应达平衡状态,d错误;正确答案b。
(3)① 从图示看出当温度选择925 ℃时,脱硝效率高,残留氨浓度较小;正确答案:脱硝效率高,残留氨浓度较小。
② 从上述流程看出,SNCR技术的反应没有使用催化剂,反应的活化能较高,因此反应温度较高;因为脱硝的主要反应是放热反应,温度过高,使脱硝反应逆向移动,脱硝效率明显降低;正确答案:没有使用催化剂,反应的活化能较高;因为脱硝的主要反应是放热反应,温度过高,使脱硝反应逆向移动(或高温下N2与O2生成了NO等合理答案)。
(4)①从题给信息看出,硝酸根离子中氮元素变为氮气,发生还原反应,该极为原电池的正极(右室);电解质溶液中的Cl 移向负极,即左室;在正极溶液中的硝酸根离子发生反应为:2NO3-+10e-+6H2O=N2↑+12OH-,产生OH-,溶液的碱性增强,pH增大;正确答案:左室;增大。
②C6H12O6在负极失电子发生氧化反应生成二氧化碳气体,极反应为:C6H12O6 – 24e + 6H2O = 6CO2↑ + 24H+;正确答案:C6H12O6 – 24e + 6H2O = 6CO2↑ + 24H+。

【题目】酸性 KMnO4 溶液能与草酸(H2C2O4)溶液反应。某化学探究小组利用反应过程中溶液紫色消失快慢的 方法来研究影响反应速率的因素。
I.实验前首先用浓度为 0.1000 mol/L 酸性 KMnO4 标准溶液滴定未知浓度的草酸溶液。
(1)写出滴定过程中发生反应的离子方程式 。
(2)下列有关一定物质的量浓度溶液配制的说法中正确的是 。
A.把 15.8 g KMnO4 固体溶于 1 L 水中所得溶液物质的量浓度为 0.1 mol/L
B.把 0.01 mol KMnO4 固体投入 100 mL 容量瓶中加水至刻度线,充分振荡后,浓度为 0.1 mol/L
C.需要 90 mL 0.1 mol/L 的 KMnO4 溶液,应准确称量 KMnO4 固体 1 58 g
D.定容时仰视容量瓶颈刻度线读数,会使配制的溶液浓度偏高
II.通过滴定实验得到草酸溶液的浓度为 0.2000 mol/L。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为 8.00 mL)。
实验编号 | 温度(℃) | 催化剂用量(g) | 酸性高锰酸钾 溶液 | |
体积(mL) | 浓度(mol/L) | |||
1 | 25 | 0.5 | 4.00 | 0.1000 |
2 | 50 | 0.5 | 4.00 | 0.1000 |
3 | 25 | 0.5 | 4.00 | 0.0100 |
4 | 25 | 0 | 4.00 | 0.1000 |
(3)写出表中实验 1 和实验 2 的实验目的: 。
(4)该小组同学对实验 1 和实验 3 分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验 编号 | 溶液褪色所需时间 (min) | ||
第 1 次 | 第 2 次 | 第 3 次 | |
1 | 14.0 | 13.0 | 11.0 |
2 | 6.5 | 6.7 | 6.8 |
分析上述数据后得出“其他条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,甲同学改进了实验方案,请简述甲同学改进 的实验方案______________。
(5)该实验中使用的催化剂应选择 MnSO4 并非 MnCl2,原因可用离子方程式表示为________。
III.工业上可用软锰矿(主要成分为 MnO2)经下列生产过程制备高锰酸钾。
①由软锰矿提取得到 MnO2,然后在 MnO2、KOH 的熔融混合物中通入空气可制得锰酸钾(K2MnO4);
②向锰酸钾溶液中通入CO2可获得高锰酸钾。
(6)第①步生产过程中,在熔融混合物中通入空气时发生反应的化学方程式:______________。
(7)向锰酸钾溶液中通入CO2可获得高锰酸钾,该反应中氧化产物与还原产物的物质的量之比为________________。