题目内容
【题目】现今太阳能光伏产业蓬勃发展,推动了高纯硅的生产与应用。回答下列问题:
Ⅰ.工业上用“西门子法”以硅石(SiO2)为原料制备冶金级高纯硅的工艺流程如下图所示:

己知:SiHCl3 室温下为易挥发、易水解的无色液体。
(1)“还原”过程需要在高温条件下,该反应的主要还原产物为_____________。
(2)“氧化”过程反应温度为200~300℃,该反应的化学方程式为__________。
(3)“氧化”、“分离”与“热解”的过程均需要在无水、无氧的条件下,原因是_________________。
(4)上述生产工艺中可循环使用的物质是_________、________(填化学式)。
Ⅱ.冶金级高纯硅中常含有微量的杂质元素,比如铁、硼等,需对其进行测定并除杂,以进一步提高硅的纯度。
(5)测定冶金级高纯硅中铁元素含量
将m g 样品用氢氟酸和硝酸溶解处理,配成V mL 溶液,用羟胺(NH2OH,难电离)将Fe3+还原为Fe2+后,加入二氮杂菲,形成红色物质。利用吸光度法测得吸光度A 为0.500(吸光度A与Fe2+浓度对应曲线如图)。

① 酸性条件下,羟胺将Fe3+还原为Fe2+,同时产生一种无污染气体,该反应的离子方程式为__________________________________。
② 样品中铁元素的质量分数表达式为____________________(用字母表示)。
(6)利用氧化挥发法除冶金级高纯硅中的硼元素
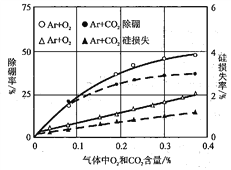
采用Ar等离子焰,分别加入O2或CO2,研究硼元素的去除率和硅元素的损失率,实验结果如下图所示。在实际生产过程,应调节O2或CO2的合理比例的原因是________________。
【答案】 Si (或 硅) Si + 3HCl![]() SiHCl3 + H2 (用
SiHCl3 + H2 (用![]() 不扣分) SiHCl3易水解而损失;氢气易燃或硅易被氧气氧化 H2 HCl 2NH2OH + 2Fe3+ = 2Fe2+ + N2↑ + 2H+ + 2H2O
不扣分) SiHCl3易水解而损失;氢气易燃或硅易被氧气氧化 H2 HCl 2NH2OH + 2Fe3+ = 2Fe2+ + N2↑ + 2H+ + 2H2O ![]() O2 含量多除硼率高但硅损失率大;CO2含量多时硅损失率小但除硼率低。因此要调节好它们的比例,使除硼率高而硅损失率低
O2 含量多除硼率高但硅损失率大;CO2含量多时硅损失率小但除硼率低。因此要调节好它们的比例,使除硼率高而硅损失率低
【解析】Ⅰ.(1)“还原”过程硅石二氧化硅与镁反应生成硅和氧化镁,需要在高温条件下,该反应的主要还原产物为硅;(2)“氧化”过程反应温度为200~300 ℃ ,硅被氯化氢氧化,该反应的化学方程式为Si + 3HCl![]() SiHCl3 + H2;(3)“氧化”、“分离”与“热解”的过程均需要在无水、无氧的条件下,因为SiHCl3易水解而损失;氢气易燃或硅易被氧气氧化;(4)上述生产工艺中可循环使用的物质是H2、HCl;
SiHCl3 + H2;(3)“氧化”、“分离”与“热解”的过程均需要在无水、无氧的条件下,因为SiHCl3易水解而损失;氢气易燃或硅易被氧气氧化;(4)上述生产工艺中可循环使用的物质是H2、HCl;
Ⅱ.(5)① 酸性条件下,羟胺将Fe3+还原为Fe 2+,同时产生一种无污染气体氮气,该反应的离子方程式为:2NH2OH + 2Fe3+ = 2Fe2+ + N2↑ + 2H+ + 2H2O;②吸光度A 为0.500,则Fe2+浓度为0.500×10-3mol/L,样品中铁元素的质量分数为![]() =
=![]() ;(6)O2 含量多除硼率高但硅损失率大;CO2含量多时硅损失率小但除硼率低。因此要调节好它们的比例,使除硼率高而硅损失率低,故在实际生产过程,应调节O2或CO2的合理比例。
;(6)O2 含量多除硼率高但硅损失率大;CO2含量多时硅损失率小但除硼率低。因此要调节好它们的比例,使除硼率高而硅损失率低,故在实际生产过程,应调节O2或CO2的合理比例。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】【化学—选修3:物质结构与性质】
钛被称为继铁、铝之后的第三金属,制备金属钛的一种流程如下:

回答下列问题:
(1)基态钛原子的价电子排布图为 ,其原子核外共有 种运动状态不相同的电子。金属钛晶胞如下图1所示,为 堆积(填堆积方式)。
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l-l >> l-b > b-b(l为孤对电子对,b为键合电子对),则关于H2O中的H-O-H键角可得出的结论是________。
A.180° | B.接近120°,但小于120° |
C.接近120°,但大于120° | D.接近109°28’,但小于109°28’ |
(3)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃,可知TiCl4为________晶体。
(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下图2。化合物乙的沸点明显高于化合物甲,主要原因是 。化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为 。

(5)钙钛矿晶体的结构如右图所示。钛离子位于立方晶胞的角顶,被 个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被 个氧离子包围。钙钛矿晶体的化学式为 。若该晶胞的边长为a pm,则钙钛矿晶体的密度为 g.cm-3(只要求列算式,不必计算出数值)。



