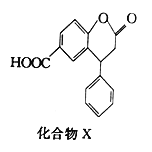
题目内容
【题目】下列说法正确的是
A.C2H6与C3H8没有同分异构体,CH2O2与C2H4O2属于同系物
B.一定条件下,乙酸乙酯、淀粉、蛋白质、乙烯都能与水发生水解反应
C.一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,则生成水的质量为18(1-a)g
D.全降解塑料(![]() )可由单体环氧丙烷(
)可由单体环氧丙烷(![]() )和CO2缩聚制得
)和CO2缩聚制得
【答案】C
【解析】
试题分析:CH2O2是甲酸, C2H4O2是乙酸或HOCH2CHO,所以CH2O2与C2H4O2不一定属于同系物,故A错误;乙烯能与水发生加成反应,故B错误;含氧质量分数为a的乙烯、乙醛混合气体,含氢质量分数为![]() ,氢元素质量为
,氢元素质量为![]() ,所以生成水的质量为18(1-a)g,故C错误;全降解塑料(
,所以生成水的质量为18(1-a)g,故C错误;全降解塑料(![]() )可由单体环氧丙烷(
)可由单体环氧丙烷(![]() )和CO2加聚制得,故D错误。
)和CO2加聚制得,故D错误。

练习册系列答案
相关题目