题目内容
【题目】某温度下,CO(g)+H2O (g)![]() CO2(g)+H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5 min时的浓度如下表所示。
CO2(g)+H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5 min时的浓度如下表所示。
甲 | 乙 | |||
起始浓度 | 5min时浓度 | 起始浓度 | 5min时浓度 | |
c(CO)/mol/L | 0.1 | 0.08 | 0.2 | x |
c(H2O)/mol/L | 0.1 | 0.08 | 0.2 | y |
下列判断不正确的是
A. x=y=0.16
B. 反应开始时,乙中反应速率比甲快
C. 平衡时,乙中的c(CO)是甲中的2倍
D. 平衡时,乙中H2O的转化率是50%
【答案】A
【解析】对于CO(g)+H2O(g)CO2(g)+H2(g),反应前后气体的体积相等;恒容条件下增加物质的量浓度,相当于增大压强,增大压强,平衡不发生移动,结合K=1计算x、y的值;物质的量浓度越大,反应速率越快;据此分析解答。
甲中起始c(CO)、c(H2O)为0.1mol/L,5min时c(CO)、c(H2O)为0.08mol/L,则CO2、H2的浓度分别为0.02mol/L,![]() <1,没有达到平衡状态,则不能与乙比较浓度关系,A错误;乙中浓度较大,则反应速率较大,B正确;平衡常数K=1,则平衡时c(CO)、c(H2O)与CO2、H2的浓度相等,因起始为0.2mol/L,则转化率为50%,因压强对平衡移动无影响,乙为甲的2倍,则c(CO)是甲中的2倍,C、D均正确;正确选项A。
<1,没有达到平衡状态,则不能与乙比较浓度关系,A错误;乙中浓度较大,则反应速率较大,B正确;平衡常数K=1,则平衡时c(CO)、c(H2O)与CO2、H2的浓度相等,因起始为0.2mol/L,则转化率为50%,因压强对平衡移动无影响,乙为甲的2倍,则c(CO)是甲中的2倍,C、D均正确;正确选项A。

【题目】某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去),请回答下列问题:
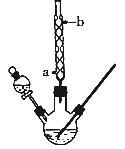
(1)球形冷凝管的作用是____________,冷凝水从____________(填“a”或“b”)处进入。
(2)已知下列数据:
乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
溶点/℃ | 117.3 | 16.6 | -83.6 | |
沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
又知温度高于140℃时发生副反应:2CH3CH2OH→CH3CH2OCH2CH3+H2O
①该副反应属于____________反应(填字母)。
a.加成反应 b.取代反应 c.酯化反应 d.消去反应
②考虑到反应速率等多种因素.用上述装置制备乙酸乙酯时,反应的最佳温度范围是____________(填字母)。
a.T<77.5℃ b.T>150℃ c.115℃<T<130℃
(3)反应结束后,欲从反应混合物中分离出乙酸乙酯,应使用的分离方法是____________(填操作方法名称,下同),所用到的主要仪器为____________,进行此步操作后,所得有机层中的主要无机物杂质是水,在不允许使用干燥剂的条件下,除去水可用____________的方法:在乙酸乙酯的同类物质的同分异构体中,有一种直链的酯在强碱条件下与新制氢氧化铜浊液混合加热一段时间后,发现生成了砖红色沉淀,请写出的化学方程式________________________。
(4)若实验所用乙酸质量为6.0g,乙醇质量为5.0g,得到纯净的产品质量为4.4g.则乙酸乙酯的产率是____________。
(5)乙二酸和乙二醇也能发生酯化反应,写出生成环酯的化学反应方程式______________________。