题目内容
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程:
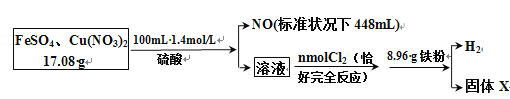
通过计算得出:
(1)原混合物中FeSO4的质量分数约为_______。
(2)通入的 n(Cl2) =________ mol。
(3)生成的H2在标准状况下的体积是________mL。
(4)固体X质量是________g。
【答案】89%0.03522400.56
【解析】
根据题中流程可知,步骤②中加入铁粉产生了氢气,说明前面的酸过量,步骤①中有氯气与亚铁离子反应,说明溶液中有亚铁离子,17.08g的FeSO4和Cu(NO3)2的混合物与0.14mol硫酸混合,由于亚铁离子过量,硝酸根全部被还原为NO,据此计算得硝酸铜的质量及消耗掉的氢离子的物质的量,同时根电子得失守恒可计算出溶液中生成的铁离子的物质的量,根据氯气的物质的量可计算出溶液中亚铁离子的物质的量,并由此计算出溶液中铁离子的总物质的量,根据溶液中的氢离子及8.96g铁粉可计算出氢气的体积和X的值。
(1)根据题中流程可知,步骤②中加入铁粉产生了氢气,说明前面的酸过量,步骤①中有氯气与亚铁离子反应,说明溶液中有亚铁离子,17.08g的FeSO4和Cu(NO3)2的混合物与0.14mol硫酸混合,硝酸根全部被还原为NO,NO的物质的量为![]() mol=0.02mol,根据氮元素守恒,样品中Cu(NO3)2的质量为188g/mol×0.01mol=1.88g,所以FeSO4的质量为17.08g﹣1.88g=15.2g,其物质的量为0.1mol,原混合物中FeSO4的质量分数为
mol=0.02mol,根据氮元素守恒,样品中Cu(NO3)2的质量为188g/mol×0.01mol=1.88g,所以FeSO4的质量为17.08g﹣1.88g=15.2g,其物质的量为0.1mol,原混合物中FeSO4的质量分数为![]() ×100%=89%;
×100%=89%;
(2)根据方程式3Fe2++8H++2NO3﹣(稀)═3Fe3++2NO↑+4H2O
3mol 8mol 2×22.4L
n(Fe2+) n(H+) 448mL
所以n(Fe2+)=0.03mol,n(H+)=0.08mol,则溶液中亚铁离子的物质的量为0.1mol﹣0.03mol=0.07mol,根据方程式2Fe2++Cl2═2Fe3++2Cl﹣,可得氧化亚铁离子需要氯气的物质的量为0.035mol;
(3)根据铁元素守恒,溶液中铁离子的物质的量为0.1mol,根据反应2Fe3++Fe═3Fe2+,可得消耗铁的物质的量为0.05mol即质量为2.8g,溶液中n(H+)=0.14mol×2﹣0.08mol=0.2mol,结合反应2H++Fe═H2↑+Fe2+,生成的氢气为0.1mol,其体积为2.44L=2240mL;
(4)可得消耗铁的物质的量为0.1mol即质量为5.6g,则剩余铁的质量为8.96g﹣5.6g﹣2.8g=0.56g。

【题目】
Ⅰ.形式一:(由粒子数推断)![]() 、
、![]() 、
、![]() 、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①
、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①![]() ;②
;②![]() 。据此,回答下列问题:写出
。据此,回答下列问题:写出![]() 、
、![]() 的化学式:____、______、
的化学式:____、______、
Ⅱ. 形式二:(由元素原子结构推断)A、B、C、D、E、F的原子序数依次增大,它们都是同周期的元素。已知:A、C、F 三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多2。
(1)写出下列元素的符号:A________,B________,E________
(2)F在元素周期表中的位置为___________________________________
(3)写出C的单质和A的最高价氧化物的水化物反应的离子方程式_______
(4)元素的非金属性为(原子的得电子能力):E________F(填“强于”或“弱于”),请以E、F为例列举元素非金属性强弱的比较方法__________________________________________________(至少2条)
通过Ⅱ的解题你认为推断出本题各元素的关键环节为___________
III.形式三:(由元素位置推断)下表为元素周期表的一部分:
族 周期 | ||||||||
1 | ① | |||||||
2 | ② | |||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)请画出元素⑦的离子结构示意图________________。
(2)写出元素⑤在周期表中的位置______________。
(3)②、③、⑥的离子半径由大到小的顺序为_________________________。
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是______。
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式:____________________。该化合物与④的最高价氧化物反应的离子方程式为____________________。
(6)请你预测:如果发现了原子序数为116号元素,它在周期表中的位置是第________周期_______族,它属于_____元素(填“金属”或“非金属”)
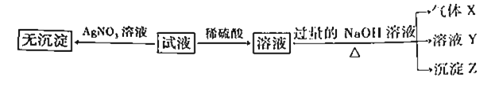
【题目】某强酸性无色溶液中可能含下表中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO32-、 |
实验Ⅰ:取少量该试液进行如下实验。
实验Ⅱ:为了进一步确定该溶液的组成,取100mL原溶液,向该溶液中滴加1mol·L-1的NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。

回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有____________种。
(2)通过实验Ⅰ可以确定该溶液中一定存在的阴离子是________________。
(3)写出实验Ⅱ的图像中BC段对应的离子方程式:_______________________________________________________________。
(4)A点对应的固体质量为____________g。
(5)该溶液中阴离子的浓度为____________mol·L-1




