题目内容
【题目】氮和氮的化合物在国防建设、工农业生产和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题:
(1)NaCN广泛用于电镀工业上,实验测得浓度相同的NaCN溶液和NaHCO3溶液,前者的pH大,则酸性:HCN___________H2CO3(填“强于”或“弱于”)。
(2)亚硝酰氯(结构式为Cl-N=O)是有机合成中的重要试剂。它可由C12和NO在通常条件下反应制得,反应方程式为:2NO(g)+Cl2(g)![]() 2ClNO(g)。已知几种化学键的键能数据如下表:
2ClNO(g)。已知几种化学键的键能数据如下表:

当Cl2与NO反应生成ClNO的过程中转移了5mol电子,理论上热量变化为___________kJ。
(3)在一个恒容密闭容器中充入2 mol NO(g)和1molCl2(g)发生(2)中反应,在温度分别为T1、T2时测得NO的物质的量(单位:mol)与时间的关系如下表所示:

①T1___________T2(填“>”“≤”或“=”),理由是___________。
②若容器容积为1L,温度为T1℃时,反应开始到5min时,C12的平均反应速率为_______。
③温度为T2℃时,在相同容器中,充入1 molNO(g)和0.5mo1Cl2(g),则NO的平衡转化率___________50%(填“大于”、“等于”或“小于”)
④温度为T2℃时,起始时容器内的压强为p0,则该反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3-),其工作原理如图所示:

①Ir表面发生反应的方程式为___________。
②若导电基体上的Pt颗粒增多,造成的结果是___________。
【答案】弱于 277.5 < 因为该反应的正反应为放热反应,温度越高,达平衡时的转化率越低(或温度越高,反应速率快,在达到平衡前,单位时间内消耗NO的量越多) 0.05mol/(L·min) 小于 ![]() H2+N2O==N2+H2O 不利于降低溶液中的含氮量
H2+N2O==N2+H2O 不利于降低溶液中的含氮量
【解析】
(1)强碱弱酸盐,越弱水解程度越大;
(2)根据焓变=反应物总键能-生成物总键能计算2NO(g)+Cl2(g)![]() 2ClNO(g)反应的焓变,转移5mol电子消耗2.5mol氯气。
2ClNO(g)反应的焓变,转移5mol电子消耗2.5mol氯气。
(3)①温度越高,反应速率越大,单位时间内消耗NO的量越多;
②根据![]() 计算5min内Cl2的反应速率;
计算5min内Cl2的反应速率;
③减小压强,平衡逆向移动;
④利用“三段式”计算Kp;
(4) ①根据图示,氢气、N2O在Ir表面生成氮气和水;
②Pt颗粒增多,更多的NO3-被还原为NH4+,不利于降低溶液中的含氮量。
(1)实验测得浓度相同的两溶液中,NaCN溶液的pH较大,则CN-水解程度比HCO3-大,则HCN的酸性弱于H2CO3。
(2)1mol Cl2参与反应发生焓变为243+2×630-2×(200+607)=-111kJ,此时转移2mol电子,则有5mol电子转移时,热量变化为277.5kJ。
(3)①温度越高,反应速率越大,单位时间内消耗NO的量越多,所以T1<T2。
②T1℃,5min内NO的物质的量0.5mol,Cl2的物质的量的变化为0.25mol,反应速率为![]() 0.05mol/(L·min)。
0.05mol/(L·min)。
③在相同容器中,充入1mol NO和0.5mol Cl2,容器中压强减小,反应向逆反应方向进行,NO转化率减小,小于50%。
④起始物质的量为3mol,压强为p0,反应后各物质变化为:
2NO + Cl2 = 2ClNO
起始物质的量 2 1 0
变化量 1 0.5 1
达平衡物质的量 1 0.5 1
同温同体积条件下,气体的压强之比等于其物质的量之比,则反应后压强为![]() ,则
,则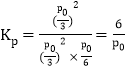 。
。
(4)①氢气、N2O在Ir表面生成氮气和水,Ir表面发生的反应为H2+N2O=H2O+N2;
②读图可知,若Pt颗粒增多,则NO3-更多转化为NH4+存在于溶液中,不利于降低溶液中的含氮量。