题目内容
【题目】(一)某化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
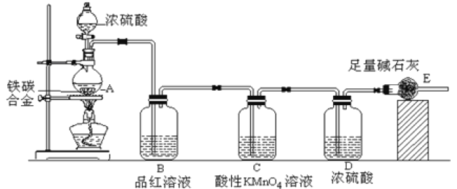
(1)仪器A的名称是___________。
(2)C装置的作用______________。
(3)该小组同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能会导致铁质量分数测量值偏低的是___________。
A.A中反应不完全
B.反应生成的SO2部分被E中碱石灰吸收
C.E中碱石灰会吸收空气中的CO2和H2O
D.反应完全后,还有CO2气体滞留在装置体系中
(二)将19.20 g CuO和Fe2O3的混合物在高温下与足量的CO充分反应,反应后全部气体用200 mL 1.20 molL-1 Ba(OH)2溶液吸收,生成35.46 g白色沉淀(不考虑沉淀的溶解,忽略溶液体积的变化)。
(4)则吸收气体后溶液中溶质的化学式为________,其浓度为_________。
(5)混合物中CuO和Fe2O3的物质的量之比为__________。
【答案】圆底烧瓶 除尽反应生成的二氧化硫 BC Ba(HCO3)2 0.3 molL-1 2:1
【解析】
(一)由装置图可知,实验原理是通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数。故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥。
(二) CuO和Fe2O3的混合物在高温下与足量的CO充分反应生成CO2,少量CO2与Ba(OH)2反应生成BaCO3,过量的CO2再与与BaCO3反应生成Ba(HCO3)2,依据反应的化学方程式解题即可。
(1)仪器A为圆底烧瓶。
(2)C中酸性高锰酸钾可以和SO2发生反应,因此C装置是为了除尽SO2,避免影响对CO2的测定。
(3)A.A中反应不完全,导致测定的CO2的质量减少,铁的质量分数增大,故A错误。
B.反应生成的SO2部分被E中碱石灰吸收,导致测定的CO2的质量增大,铁的质量分数减小,故B正确。
C.E中碱石灰会吸收空气中的CO2和H2O,导致测定的CO2的质量增大,铁的质量分数减小,故C正确。
D.装置中残留的CO2没有完全被E吸收,导致测定的CO2的质量减少,铁的质量分数增大,故D错误。本题选BC。
(二) (4)发生反应为CO2+Ba(OH)2=BaCO3↓+H2O①、CO2+H2O+BaCO3=Ba(HCO3)2②。生成35.46 g白色沉淀BaCO3,根据化学方程式①可求得参加反应①的n1[Ba(OH)2]=n(BaCO3)=![]() =0.18mol,参与反应②的n2[Ba(OH)2]=0.2 L×1.20 molL-1-0.18mol =0.06 mol,根据化学方程式②列比例式可得n[Ba (HCO3)2]=0.06 mol,c[Ba (HCO3)2]=
=0.18mol,参与反应②的n2[Ba(OH)2]=0.2 L×1.20 molL-1-0.18mol =0.06 mol,根据化学方程式②列比例式可得n[Ba (HCO3)2]=0.06 mol,c[Ba (HCO3)2]=![]() =0.3 mol/L。吸收后溶液的溶质为Ba (HCO3)2。
=0.3 mol/L。吸收后溶液的溶质为Ba (HCO3)2。
(5)参与反应①的n1(CO2)= n1[Ba(OH)2]=0.18mol,参与反应②的n2(CO2)= n2[Ba(OH)2]+ n2(BaCO3)=0.12mol,因为生成的CO2全部参与了反应,n(CO2)= 0.18mol+0.12mol=0.3mol。设CuO和Fe2O3的物质的量分别为x mol、y mol,根据化学方程式CuO+CO![]() Cu+CO2、Fe2O3+3CO
Cu+CO2、Fe2O3+3CO![]() 2Fe+3CO2,列方程组80x+160y=19.2①,x+3y=0.3②,解得x=0.12 mol,y=0.06 mol。CuO和Fe2O3的物质的量之比为2∶1。
2Fe+3CO2,列方程组80x+160y=19.2①,x+3y=0.3②,解得x=0.12 mol,y=0.06 mol。CuO和Fe2O3的物质的量之比为2∶1。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案【题目】我国高铁、航空航天、手机制造等都已经跻身世界一流水平,根据下列材料的应用回答问题。
应用 | “复兴号”高铁车轮 | “鲲龙”水陆两栖飞机零部件 | 华为折叠手机屏幕 |
用到的材料 | 高速钢 | 钛合金、铝合金 | 聚酰亚胺塑料 |
(1)上述材料中属于有机合成材料的是______,属于金属材料的是______(写一种即可)。
(2)飞机外壳用钛合金、铝合金的优点是______。
(3)在对高铁钢轨中的缝隙进行焊接时,常用铝和氧化铁在高温条件下反应生成熔融状态下的铁和另一种氧化物。写出该反应的化学方程式为______,反应基本类型是______。






