��Ŀ����
����Ŀ��ú��������Ҫ��Ӧ��ú��̼��ˮ������Ӧ����CO��H2�ȣ��ش��������⣺
��1��CO��H2�ֱ���O2��������Ƴ�ȼ�ϵ�أ�CO��O2��Ƴ�ȼ�ϵ�أ�������̼����Ϊ����ʣ������ĵ缫��ӦΪ
��2����ú��������õĻ���ԭ�����к��������ʻ���COS������������ж���������Ⱦ�ȣ�COS�ĵ���ʽΪ�ʻ������ռ���Һ��Ӧ����ˮ���������ε����ӷ���ʽΪ�ʻ�������������ַ������䷴Ӧʽ�ֱ�Ϊ�� ����ⷴӦ��COS��g��+H2��g���TH2S��g��+CO��g����H1=+7kJ/mol
��ˮ�ⷴӦ��COS��g��+H2O��g���TH2S��g��+CO2��g����H2
��֪��Ӧ����صĻ�ѧ�������������
��ѧ�� | C=O��CO2�� | C=O��COS�� | C=S | H��S | H��O |
���ܣ�kJ/mol�� | 803 | 742 | 577 | 339 | 465 |
���H2=kJ/mol
��3�����������CO��H2�ڴ��������ºϳɼ״���CO2��g��+3H 2��g��CH3OH��g��+H2O��g����H2=��90.14kJ/mol���÷�Ӧ���Է��������� �� ��һ���¶��£��������ݻ���ΪVL�ĺ����ܱ������У������·�ʽ��Ӧ�һ��ʱ���ﵽƽ��
���� | �� | �� |
��Ӧ��Ͷ���� | 1molCO2��3molH2 | mmolCO2��3mmolH2�� |
������ƽ��������ѹǿΪ��ʼ��0.8����Ҫʹƽ������������ͬ��ֵ����������ȣ�����ʼʱά�ֻ�ѧ��Ӧ���淴Ӧ������У���n��ȡֵ��ΧΪ �� ��Ӧ��ƽ�ⳣ��K= ��
�ڼ��������ֺ��ݣ�������H2��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ���������㼴�ɣ���
���𰸡�
��1��CO��2e��+CO32��=2CO2
��2��![]() ��COS+4NaOH=Na2S+Na2CO3+2H2O����35
��COS+4NaOH=Na2S+Na2CO3+2H2O����35
��3���÷�Ӧ���ʼ����ؼ���Ӧ������ʱ�Է���0.4��n��1��0.046V2������CO��Ͷ������������״����ʵ�����
���������⣺��1���е��������Һ��ɵ�CO��O2��ȼ�ϵ�أ����ڸ����Ϸŵ����CO����ӦΪCOʧ���ӽ��CO32������CO2��������ӦΪCO��2e��+CO32��=2CO2 �� ���Դ��ǣ�CO��2e��+CO32��=2CO2����2���ʻ�������������̼���ӽṹ���ƣ���Ϊֱ���ͣ������ʽΪ ![]() ���ʻ������ռ���Һ��Ӧˮ��Na2S��Na2CO3 �� ��ӦΪCOS+4NaOH=Na2S+Na2CO3+2H2O����ij��Ӧ��4mol���ӷ���ת�ƣ���÷�Ӧ��������Ϊ14kJ��COS��g��+H2O��g���TH2S��g��+CO2��g�����ʱ�=��742+465��2������339+803��=��35kJ/mol��
���ʻ������ռ���Һ��Ӧˮ��Na2S��Na2CO3 �� ��ӦΪCOS+4NaOH=Na2S+Na2CO3+2H2O����ij��Ӧ��4mol���ӷ���ת�ƣ���÷�Ӧ��������Ϊ14kJ��COS��g��+H2O��g���TH2S��g��+CO2��g�����ʱ�=��742+465��2������339+803��=��35kJ/mol��
���Դ��ǣ� ![]() ��COS+4NaOH=Na2S+Na2CO3+2H2O����35����3����֪CO2��g��+3H 2��g��CH3OH��g��+H2O��g���ġ�H2��0����S��0�����ݡ�G=��H��T��S�������¡�G��0����Ӧ���Է��Ľ��У�
��COS+4NaOH=Na2S+Na2CO3+2H2O����35����3����֪CO2��g��+3H 2��g��CH3OH��g��+H2O��g���ġ�H2��0����S��0�����ݡ�G=��H��T��S�������¡�G��0����Ӧ���Է��Ľ��У�
���Դ��ǣ��÷�Ӧ���ʼ����ؼ���Ӧ������ʱ�Է���
����ƽ��ʱ������̼ת����xmol��
CO2��g��+ | 3H2��g�� | CH3OH��g��+ | H2O��g���� | |
��ʼ1��mol�� | 1 | 3 | 0 | 0 |
�仯1��mol�� | X | 3x | X | X |
ƽ��1��mol�� | 1-x | 3-3x | X | X |
��ʼ2 | a | 3a | n | N |
���������֪�� ![]() =0.8�����x=0.4��
=0.8�����x=0.4��
���ݺ��º��������µĵ�Чƽ���˼�����п�ʼ1�Ϳ�ʼ2Ϊ��ȫ��Ч����a+n=1��Ҫʹ��Ӧʼ����������У���n��x����a�ķ�ΧΪ0.4��n��1��
�˷�Ӧ��ƽ�ⳣ��K= ![]() =
= 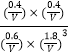 =0.046V2��
=0.046V2��
���Դ��ǣ�0.4��n��1��0.046V2���ڶ��ڷ�ӦCO2��g��+3H 2��g��CH3OH��g��+H2O��g������CO��Ͷ������������״����ʵ����¾���ʹƽ�������ƶ���ʹH2��ƽ��ת��������
���Դ��ǣ�����CO��Ͷ������������״����ʵ����£�
�����㾫����ͨ��������÷�Ӧ�Ⱥ��ʱ�ͻ�ѧƽ��״̬���ʼ������������ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ���ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч�������Խ����⣮

 Ӣ�żƻ���ĩ����ϵ�д�
Ӣ�żƻ���ĩ����ϵ�д� ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д�����Ŀ�������ڱ��������ڵڢ�����Ԫ�أ��仯�ϼ���;�㷺���磺LiCoO2��﮵�ص��������ϣ������ܿ�����ָʾ���ʹ����Ʊ���
��1���� LiCoO2����Ԫ�صĻ��ϼ�Ϊ ��
��2����ҵ�Ͻ���﮵�ص��������������������Һ��ϡ�����ϼ��ȣ��ɵõ�CoSO4���գ���Ӧ�Ļ�ѧ����ʽΪ�����������H2SO4��H2O2�Ļ��Һ����ȱ���� ��
��3���� ����һ�ֺ��ܿ�ʯ[��Ҫ�ɷ�ΪCo2O3 �� ������Fe2O3��Al2O3��MnO��MgO��CaO��]��ȡCoC2O42H2O�����������£� 
��֪����֪���ٽ���Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Ca2+��Mg2+��Al3+�ȣ�
�ڲ���������������������ʽ����ʱ��Һ��pH������
������ | Fe��OH��3 | Fe��OH��2 | Co��OH��2 | Al��OH��3 | Mn��OH��2 |
��ȫ������pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
���������м���NaClO3��Ŀ���� ��
��4������ƽ���ƶ�ԭ��˵����Na2CO3��PH��5.2���ɳ�����ԭ�� ��
��5����Һ���м�����ȡ���������� ��
��6�������ơ�þ���ǽ���Һ��Ca2+��Mg2+ת��ΪMgF2��CaF2��������֪ij�¶��£�Ksp��MgF2��=7.35��10��11 �� Ksp��CaF2��=1.05��10��10 �� ���������NaF��������Һc��Mg2+��/c��Ca2+��= ��