��Ŀ����
����Ŀ�������ڱ��������ڵڢ�����Ԫ�أ��仯�ϼ���;�㷺���磺LiCoO2��﮵�ص��������ϣ������ܿ�����ָʾ���ʹ����Ʊ���
��1���� LiCoO2����Ԫ�صĻ��ϼ�Ϊ ��
��2����ҵ�Ͻ���﮵�ص��������������������Һ��ϡ�����ϼ��ȣ��ɵõ�CoSO4���գ���Ӧ�Ļ�ѧ����ʽΪ�����������H2SO4��H2O2�Ļ��Һ����ȱ���� ��
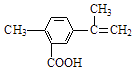
��3���� ����һ�ֺ��ܿ�ʯ[��Ҫ�ɷ�ΪCo2O3 �� ������Fe2O3��Al2O3��MnO��MgO��CaO��]��ȡCoC2O42H2O�����������£� 
��֪����֪���ٽ���Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Ca2+��Mg2+��Al3+�ȣ�
�ڲ���������������������ʽ����ʱ��Һ��pH������
������ | Fe��OH��3 | Fe��OH��2 | Co��OH��2 | Al��OH��3 | Mn��OH��2 |
��ȫ������pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
���������м���NaClO3��Ŀ���� ��
��4������ƽ���ƶ�ԭ��˵����Na2CO3��PH��5.2���ɳ�����ԭ�� ��
��5����Һ���м�����ȡ���������� ��
��6�������ơ�þ���ǽ���Һ��Ca2+��Mg2+ת��ΪMgF2��CaF2��������֪ij�¶��£�Ksp��MgF2��=7.35��10��11 �� Ksp��CaF2��=1.05��10��10 �� ���������NaF��������Һc��Mg2+��/c��Ca2+��= ��
���𰸡�
��1��+3
��2��2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2+4H2O�����ɵ����������Ⱦ���������ӷ����˷Ѻܴ�
��3����Fe2+����ΪFe3+ �� ���ڴӻ��Һ�г�ȥ
��4����Fe3+��Al3+����M3+���棩��ˮ��Һ�д���ƽ��M3++H2O?M��OH��3+3H+ �� ����̼���ƺ�CO32����H+��������ѵ����HCO3�� �� ʹˮ��ƽ�����ƶ���������
��5����ȥMn2+
��6��0.7
���������⣺��1������ﮣ�LiCoO2����LiΪ+1�ۣ�OΪ��2�ۣ�����Ԫ�صĻ��ϼ�Ϊ+3�� ���Դ��ǣ�+3����2�����ʱ��Ӧ�������ᡢ���������Լ�LiCoO2 �� ��������Li2SO4��CoSO4 �� CoԪ�ػ��ϼ۽��ͣ���������ⱻ����Ϊ������ͬʱ����ˮ����Ӧ����ʽΪ��2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2+4H2O����Ϊ����Ҳ����ǿ���Ժͻ�ԭ�ԣ������Ͽ��Դ���H2SO4��H2O2 �� ��������Ӧ��֪LiCoO2����ǿ�����ԣ�������������Ⱦ�������������ɣ�
���Դ��ǣ�2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2+4H2O�����ɵ����������Ⱦ���������ӷ����˷Ѻܴ�
��3��ҪʹFe2+������pH=9.6��Co2+������pH=9.2����ֱ�ӳ���Fe2+ �� ��Һ�е�Co2+Ҳ����������Fe3+������pH=3.7�����Լ�NaClO3������Һ��Fe2+����ΪFe3+ �� ���ڴӻ��Һ�г�ȥ��
���Դ��ǣ���Fe2+����ΪFe3+ �� ���ڴӻ��Һ�г�ȥ����4����Na2CO3��PH=5.2��ʹFe3+��Al3+ ����ת�����������������ԭ���ǣ���Fe3+��Al3+����M3+���棩��ˮ��Һ�д���ƽ��M3++H2OM��OH��3+3H+ �� ����̼���ƺ�CO32����H+��������ѵ����HCO3�� �� ʹˮ��ƽ�����ƶ�����������
���Դ��ǣ���Fe3+��Al3+����M3+���棩��ˮ��Һ�д���ƽ��M3++H2OM��OH��3+3H+ �� ����̼���ƺ�CO32����H+��������ѵ����HCO3�� �� ʹˮ��ƽ�����ƶ�������������5���ɹ������̿�֪��Һ�е������ӻ�δ��ȥ�����յõ������ܣ�˵����Һ�м�����ȡ���������dz�ȥ�����ӣ�
���Դ��ǣ���ȥMn2+����6�����ܶȻ���֪����Һ���ơ�þ���ǽ���Һ��Ca2+��Mg2+ת��ΪCaF2��MgF2�����������ܶȻ���֪c��Mg2+����c��Ca2+��= ![]() =
= ![]() =0.7��
=0.7��
���Դ��ǣ�0.7��

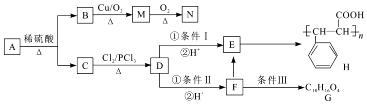
����Ŀ��ú��������Ҫ��Ӧ��ú��̼��ˮ������Ӧ����CO��H2�ȣ��ش��������⣺
��1��CO��H2�ֱ���O2��������Ƴ�ȼ�ϵ�أ�CO��O2��Ƴ�ȼ�ϵ�أ�������̼����Ϊ����ʣ������ĵ缫��ӦΪ
��2����ú��������õĻ���ԭ�����к��������ʻ���COS������������ж���������Ⱦ�ȣ�COS�ĵ���ʽΪ�ʻ������ռ���Һ��Ӧ����ˮ���������ε����ӷ���ʽΪ�ʻ�������������ַ������䷴Ӧʽ�ֱ�Ϊ�� ����ⷴӦ��COS��g��+H2��g���TH2S��g��+CO��g����H1=+7kJ/mol
��ˮ�ⷴӦ��COS��g��+H2O��g���TH2S��g��+CO2��g����H2
��֪��Ӧ����صĻ�ѧ�������������
��ѧ�� | C=O��CO2�� | C=O��COS�� | C=S | H��S | H��O |
���ܣ�kJ/mol�� | 803 | 742 | 577 | 339 | 465 |
���H2=kJ/mol
��3�����������CO��H2�ڴ��������ºϳɼ״���CO2��g��+3H 2��g��CH3OH��g��+H2O��g����H2=��90.14kJ/mol���÷�Ӧ���Է��������� �� ��һ���¶��£��������ݻ���ΪVL�ĺ����ܱ������У������·�ʽ��Ӧ�һ��ʱ���ﵽƽ��
���� | �� | �� |
��Ӧ��Ͷ���� | 1molCO2��3molH2 | mmolCO2��3mmolH2�� |
������ƽ��������ѹǿΪ��ʼ��0.8����Ҫʹƽ������������ͬ��ֵ����������ȣ�����ʼʱά�ֻ�ѧ��Ӧ���淴Ӧ������У���n��ȡֵ��ΧΪ �� ��Ӧ��ƽ�ⳣ��K= ��
�ڼ��������ֺ��ݣ�������H2��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ���������㼴�ɣ���
����Ŀ���������������������������������ӦΪ2NO2��g��+O3��g��N2O5��g��+O2��g������T�¶��£���2.0L�����ܱ������г���2.0mol NO2��1.0mol O3 �� ����һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ�IJ������ݼ��±���
t/s | 0 | 3 | 6 | 12 | 24 |
n��O2��/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
�����й�˵����ȷ���ǣ� ��
A.��Ӧ��0��3 s�ڵ�ƽ������v��NO2��=0.24 molL��1s��1
B.24 s�������������������䣬�����¶ȣ��ﵽ��ƽ��ʱ���c��O2��=0.44 molL��1 �� ��Ӧ�ġ�H��0
C.��T�¶��£���ʼʱ�������г���1.0 mol NO2��0.5 mol O3��0.50 mol N2O5��0.50 mol O2 �� ��Ӧ�ﵽƽ��ʱ��ѹǿΪ��ʼʱ��0.88��
D.��T�¶��£���ʼʱ�������г���2.0 mol N2O5��2.0 mol O2 �� �ﵽƽ��ʱ��N2O5��ת���ʴ���20%