题目内容
下列实验过程中曲线变化不正确的是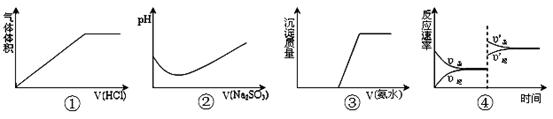
| A.①表示Na2CO3溶液中滴入稀盐酸 |
| B.②表示溴水中滴入Na2SO3溶液 |
| C.③表示HCl和MgCl2溶液中滴入氨水 |
D.④表示一定条件下反应:2SO2+O2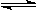 2SO3 ΔH< 0 ,达平衡后,增大压强 2SO3 ΔH< 0 ,达平衡后,增大压强 |
A
解析试题分析:A.反应CO32-+H+=HCO3- HCO3-+H+=CO2↑+H2O,开始时没有气体产生,错误;B.Br2+SO32-+H2O=2Br-+SO42-+2H+,前一段时间有溴存在的时候,由方程式可知PH会下降,但当溴反应完后,由于亚硫酸钠是强碱弱酸盐显碱性,继续加入则PH上升,正确;C.氨水先和HCl反应,再和MgCl2溶液反应,所以在有盐酸存在时,没有沉淀产生,正确;D.增大压强,同时增大正逆反应速率,同时平衡向着体积减小的方向移动,即向正反应方向移动,所以正反应速率大于逆反应速率,正确。
考点:碳酸钠溶液与盐酸反应的特点;亚硫酸钠溶液的性质;优先反应的特点;影响化学平衡移动的因素。

练习册系列答案
相关题目
可逆反应A(g)+ 4B(g) C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
| A.vA==0.15mol/(L·min) | B.vB="=0.6" mol/(L·min) |
| C.vC="=0.4" mol/(L·min) | D.vD="=0.01" mol/(L·s) |
一定条件下,向密闭恒容容器中加入1.0 mol·L-1X,发生反应:2X(g)  Y(g)+Z(g) △H<0,反应到8min时达到平衡;在14min时改变体系的温度, 16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是
Y(g)+Z(g) △H<0,反应到8min时达到平衡;在14min时改变体系的温度, 16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是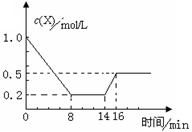
| A.0~8min用Y表示该反应速率为0.1mol·L-1·min-1 |
| B.8min时达到平衡,该反应的平衡常数为K= 0.5 |
| C.14min时,改变的反应条是降低了温度 |
| D.16min时的正反应速率比8min时的正反应速率大 |
反应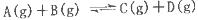 过程中的能量变化如图所示,下列说法错误的是
过程中的能量变化如图所示,下列说法错误的是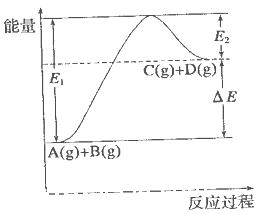
| A.该反应是吸热反应 |
| B.加入催化剂后,反应加快,A的转化率不变 |
| C.反应物的总键能小于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |
在密闭容器中发生反应: aX(g)+bY(g) 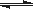 cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述正确的是( )
cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述正确的是( )
| A.平衡向正反应方向移动 | B.(a+b)>(c+d) |
| C.Z的体积分数变大 | D.X的转化率变小 |
下列说法正确的是
A.已知2SO2(g)+ O2(g) 2SO3 (g)△H<0,该反应在任何温度下均可自发进行 2SO3 (g)△H<0,该反应在任何温度下均可自发进行 |
| B.0.01 mol·L-1NaHCO3溶液中c(Na+)= c(HCO3-)+ 2c(CO32-)+ c(H2CO3) |
| C.25℃,0.1mol·L-1 K2CO3溶液中c(H+)/ c(OH-) ="l.0" × l0-a,该溶液的pH=7+0.5a |
| D.室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和NaCl的混合稀溶液中滴加0.01 mol·L-1AgNO3溶液,先生成Ag2CrO4沉淀 |
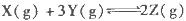 为放热反应,一定温度下在密闭容器中进行反应,
为放热反应,一定温度下在密闭容器中进行反应,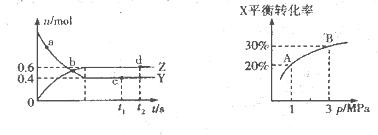
 N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是