题目内容
已知反应: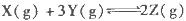 为放热反应,一定温度下在密闭容器中进行反应,
为放热反应,一定温度下在密闭容器中进行反应,
下图是该反应达平衡及改变条件平衡移动的图像。下列说法正确的是
A.图中的a、b、c、d都是平衡点
B.起始时,加入Y的物质的量为1.3 mol ,
C.c点和d点表示正反应速率大于逆反应速率
D.在3 MPa和1 MPa条件下,反应达平衡时,放出的热量:Q(A)>Q(B)
B
解析试题分析:A、a点不是平衡点,b点代表Y、Z的物质的量相同,但不是平衡点,错误;B、平衡时Z的物质的量增加0.6mol,则消耗Y的物质的量是0.9mol,平衡时Y的物质的量是0.4mol,所以起始时Y的物质的量是1.3mol,正确;C、c、d均是平衡状态,所以正逆反应速率相等,错误;D、压强增大该反应正向移动,X的转化率增大,所以B放出的热量大于A放出的热量,错误,答案选B。
考点:考查对图像的分析,平衡状态的判断,物质的量的计算,平衡移动的判断

工业制硫酸中的一步重要反应是SO2(在400-500 C下的催化氧化:2SO2+O2
C下的催化氧化:2SO2+O2 2SO3,这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下述有关说法错误的是
2SO3,这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下述有关说法错误的是
| A.在上述条件下,SO2可能100%的转化为SO3 |
| B.使用催化剂是为了加快反应速率,提高生产效率 |
| C.达到平衡时,SO2与SO3的浓度保持不变 |
| D.为了提高SO2的转化率,可以适当提高O2的浓度 |
25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )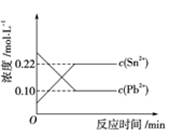
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0 |
| D.25 ℃时,该反应的平衡常数K=2.2 |
T℃时在2L的密闭容器中X(g)与Y (g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图l所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是
A.容器中发生的反应可表示为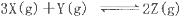 |
B.反应进行的前3 min内,用X表示的反应速率 |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
少量铁片与l00 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
| A.①⑥⑦ | B.③⑤⑧ | C.③⑦⑧ | D.③④⑥⑦⑧ |
下列实验过程中曲线变化不正确的是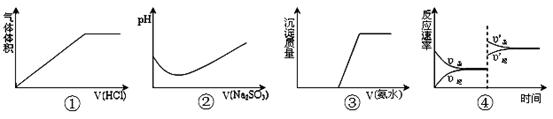
| A.①表示Na2CO3溶液中滴入稀盐酸 |
| B.②表示溴水中滴入Na2SO3溶液 |
| C.③表示HCl和MgCl2溶液中滴入氨水 |
D.④表示一定条件下反应:2SO2+O2 2SO3 ΔH< 0 ,达平衡后,增大压强 2SO3 ΔH< 0 ,达平衡后,增大压强 |
在2 L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g) 3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是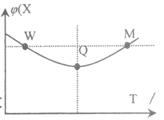
| A.升高温度,平衡常数增大 |
| B.W点X的正反应速率等于M点X的正反应速率 |
| C.Q点时,Y的转化率最大 |
| D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大 |
下列各示意图与对应的表述正确的是: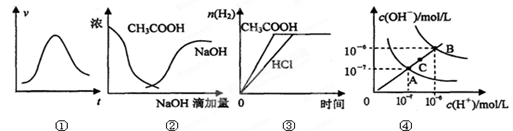
| A.图①表示一定条件下某化学反应的速率随时间变化的趋势图,该反应一定为放热反应 |
| B.图②中曲线表示将氢氧化钠溶液滴加到醋酸溶液浓度的变化趋势图 |
| C.图③表示等体积、等物质的量浓度的盐酸和醋酸,分别加足量镁粉,产生H2的物质的量的变化 |
| D.图④为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
 2B(g)+C(g)ΔH<0,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是
2B(g)+C(g)ΔH<0,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是