题目内容
下列变化中,需加入适当的氧化剂才能完成的是
| A.Fe → FeCl3 | B.CuO → Cu | C.HNO3 → NO | D.SO3 → H2SO4 |
A
解析试题分析:需加入适当的氧化剂才能完成说明选项中的物质作还原剂,失去电子,化合价升高。A.Fe的化合价由反应前单质中的0价变为反应后FeCl3中的+3价。符合题意。正确。B.CuO → Cu 化合价由反应前的+2价变为反应后单质中的0价,化合价降低,不符合题意。错误。C.HNO3 → NO N的化合价有反应前的+5价变为反应后的+2价,化合价降低,不符合题意。错误。D. SO3 → H2SO4反应前后元素的化合价不变,没有发生氧化还原反应,不符合题意。错误。
考点:考查氧化还原反应中化合价的升降与反应实质、反应类型的关系的知识。

 阅读快车系列答案
阅读快车系列答案单质硫在KOH的热溶液中发生岐化反应:3 S + 6 KOH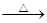 2 K2S + K2SO3 + 3 H2O
2 K2S + K2SO3 + 3 H2O
若硫过量,进一步生成K2Sx(x ≤ 5)和K2S2O3。将0.08 mol单质硫与含0.06 mol KOH的热溶液充分反应恰好生成a mol K2Sx和b mol K2S2O3,再加入足量KClO-KOH的混合溶液,硫元素全部转化为K2SO4,转移电子n mol。则以下正确的是
| A.a = 2b | B.x = 2 | C.n = 0.48 | D.b = 0.02 |
火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2 下列说法正确的是
| A.Cu2S既是氧化产物又是还原产物 |
| B.每生成1 molCu2S,有4mol硫被氧化 |
| C.CuFeS2仅作还原剂,硫元素被氧化 |
| D.每转移1.2 mol电子,有0.2 mol硫被氧化 |
下列关于 NO2跟 H2O反应的说法中,正确的是( )。
| A.NO2只作氧化剂 | B.NO2只作还原剂 |
| C.NO2既作氧化剂,又作还原剂 | D.NO2既不作氧化剂,又不作还原剂 |
两种大气污染物NO2和SO2在一定条件下可以发生如下反应:NO2+SO2=" NO" +SO3,在体积为V L的密闭容器中通入3molNO2和5molSO2, 反应后容器内氮原子和氧原子个数比为( )
| A.3/10 | B.16/3 | C.3/16 | D.5/16 |
在反应3Cl2+8 NH3 = N2+6NH4Cl中,氧化剂与还原剂的物质的量之比为( )
| A.8:3 | B.3:8 | C.3:2 | D.1:3 |
化学工业是国民经济的支柱产业,下列生产过程中不涉及氧化还原反应的是
| A.纯碱厂用侯氏制碱法制纯碱 | B.硝酸厂用氨氧化法制硝酸 |
| C.硫酸厂用接触法生产硫酸 | D.氮肥厂用氮气和氢气合成氨气 |
在AlCl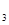 和FeCl
和FeCl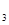 混合溶液中,先加入过量的KI溶液,再加入足量的Na
混合溶液中,先加入过量的KI溶液,再加入足量的Na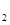 S溶液,所得 到的沉淀物是
S溶液,所得 到的沉淀物是
A.Fe(OH)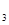 、Al(OH) 、Al(OH)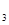 | B.Al(OH)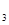 、I 、I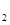 |
C.Fe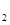 S S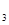 、I 、I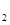 | D.FeS、S、Al(OH)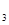 |
锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量为世界第一,从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
①2Sb2S3+3O2+6Fe Sb4O6+6FeS②Sb4O6+6C
Sb4O6+6FeS②Sb4O6+6C 4Sb+6CO↑,关于反应①、②的说法正确的是( )
4Sb+6CO↑,关于反应①、②的说法正确的是( )
A.反应①②中的氧化剂分别是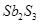 、 、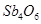 |
| B.反应①中每生成1mol FeS时,共转移3mol电子 |
| C.反应②说明高温下C的还原性比Sb强 |
| D.每生成4mol Sb时,反应①与反应②中还原剂的物质的量之比为4:3 |