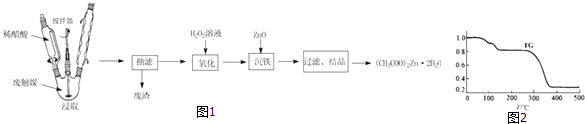
��Ŀ����
����Ŀ����������ṹ�����Ŀ��
��1���ù��ʾ��ͼ��ʾFe3+�ļ۵����Ų� ��
��2��ij����Ԫ�صĵ����ܣ����ӷ��أ����£�
I1 | I2 | I3 | I4 | I5 | I6 | I7 |
14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
�жϸ�Ԫ�ش����壻
��3����ABn������ԭ��A��û��δ�����γɹ��ۼ��ŶԵ��ӣ����ü۲���ӶԻ���ģ�ͣ�����˵����ȷ����������ĸ����
A.��n=2������ӵ����幹��ΪV��
B.��n=3������ӵ����幹��Ϊ������
C.��n=4������ӵ����幹��Ϊ����������
D.����˵��������ȷ
��4���������ӵĽṹ��ͼ1����V�ͣ�����116.5�㣮��ش𣺢ٳ����������Ĺ�ϵ�� ��
�����з�����������ӵĽṹ�����Ƶ���������ĸ����
A��H2O B��CO2 C��SO2 D��BeCl2
�۳��������Ƿ�Ϊ���Է�������ǡ�����
��5���ڶ�����Ԫ���У�������Ԫ����ɵļ������Ӽ����й��ۼ�����λ�����������������������������8���������ʵĵ���ʽ ��
��6��������Ϊ�������ܶѻ��ṹ������ѵ�ԭ�Ӱ뾶Ϊr�������ṹ��ͼ2��ʾ����þ����ı߳�a= �� b=���ú�r�Ĵ���ʽ��ʾ��
���𰸡�
��1��![]()
��2��VA
��3��C
��4��ͬ�������壻C����
��5��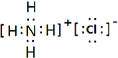
��6��2r��![]() r
r
���������⣺��1��Fe3+�ļ۵���Ϊ3d5 �� ���ݺ��ع���ͱ���������ԭ��������ʾ��ͼΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����2����Ԫ�ص��������ܾ�������Ԫ��ԭ������������Ϊ5������VA�壬���Դ��ǣ�VA����3�����ݼ۲���ӶԻ�������֪����ABn�ͷ��ӵ�����ԭ��A��û��δ�����γɹ��ۼ��ŶԵ��ӣ���n=2������ӵ����幹��Ϊֱ���Σ���n=3������ӵ����幹��Ϊƽ�������Σ���n=4������ӵ����幹��Ϊ���������Σ���ѡ��C����4����O2��O3��������Ԫ���γɵIJ�ͬ���ʣ���Ϊͬ�������壬���Դ��ǣ�ͬ�������壻�ڶ�����̼��BeCl2Ϊֱ���ͣ�ˮΪV�νṹ���������ڴ�м����ڳ���O3�У����ĵ���ԭ����sp2�ӻ��������Ե���λ��ԭ�Ӽ������������Ҽ���ʹO3���ӳ������Σ���������ԭ��֮�仹������һ����ֱ�ڷ���ƽ��Ĵ�м����������Ħм��������ĵ���ԭ���ṩ����p���ӡ�����������λ��ԭ�Ӹ��ṩһ��p�����γɵģ�SO2���ӳʡ�V�����νṹ����ɼ���ʽ��O3���ƣ�Sԭ��sp2�ӻ���Sԭ�Ӻ��������ԭ�ӳ��ԦҼ�������⣬���γ�һ���������ĵ��ӵĴ�м�����ѡ��C����O3�е�����Oԭ��Ϊsp2�ӻ�������ģ��Ϊƽ�������Σ����ӹ���ΪV�ͣ�����O3�γɵ����������ĵ��Ӵ�м����ռ乹�Ͳ��Գƣ�����������IJ��غϣ������Ǽ��Է��ӣ����Դ��ǣ��ǣ���5�������ַǽ���Ԫ���γɵ���֦������Һ��й��ۼ���ӦΪ��Σ������������������������8����ӦΪ�Ȼ�泥���ѧʽΪNH4Cl������ʽΪ
����2����Ԫ�ص��������ܾ�������Ԫ��ԭ������������Ϊ5������VA�壬���Դ��ǣ�VA����3�����ݼ۲���ӶԻ�������֪����ABn�ͷ��ӵ�����ԭ��A��û��δ�����γɹ��ۼ��ŶԵ��ӣ���n=2������ӵ����幹��Ϊֱ���Σ���n=3������ӵ����幹��Ϊƽ�������Σ���n=4������ӵ����幹��Ϊ���������Σ���ѡ��C����4����O2��O3��������Ԫ���γɵIJ�ͬ���ʣ���Ϊͬ�������壬���Դ��ǣ�ͬ�������壻�ڶ�����̼��BeCl2Ϊֱ���ͣ�ˮΪV�νṹ���������ڴ�м����ڳ���O3�У����ĵ���ԭ����sp2�ӻ��������Ե���λ��ԭ�Ӽ������������Ҽ���ʹO3���ӳ������Σ���������ԭ��֮�仹������һ����ֱ�ڷ���ƽ��Ĵ�м����������Ħм��������ĵ���ԭ���ṩ����p���ӡ�����������λ��ԭ�Ӹ��ṩһ��p�����γɵģ�SO2���ӳʡ�V�����νṹ����ɼ���ʽ��O3���ƣ�Sԭ��sp2�ӻ���Sԭ�Ӻ��������ԭ�ӳ��ԦҼ�������⣬���γ�һ���������ĵ��ӵĴ�м�����ѡ��C����O3�е�����Oԭ��Ϊsp2�ӻ�������ģ��Ϊƽ�������Σ����ӹ���ΪV�ͣ�����O3�γɵ����������ĵ��Ӵ�м����ռ乹�Ͳ��Գƣ�����������IJ��غϣ������Ǽ��Է��ӣ����Դ��ǣ��ǣ���5�������ַǽ���Ԫ���γɵ���֦������Һ��й��ۼ���ӦΪ��Σ������������������������8����ӦΪ�Ȼ�泥���ѧʽΪNH4Cl������ʽΪ 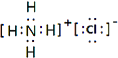 �����Դ��ǣ�
�����Դ��ǣ� 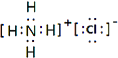 ����6���ϵ������ϵ�ԭ�����ڣ����Եó���a=2r���ڲ�ԭ�����ϵ��桢���µ���3��ԭ�������Ҿ��γ���������ṹ����bΪ��������ߵ�2��������������ⳤΪ2r����������������Ϊ2r��
����6���ϵ������ϵ�ԭ�����ڣ����Եó���a=2r���ڲ�ԭ�����ϵ��桢���µ���3��ԭ�������Ҿ��γ���������ṹ����bΪ��������ߵ�2��������������ⳤΪ2r����������������Ϊ2r�� ![]() =
= ![]() r���������ĵ��ߵľ���Ϊ
r���������ĵ��ߵľ���Ϊ ![]() r��
r�� ![]() ���ɹ��ɶ�����֪��������ĸ�Ϊ
���ɹ��ɶ�����֪��������ĸ�Ϊ ![]() =
= ![]() r����b=2��
r����b=2�� ![]() r=
r= ![]() r�����Դ��ǣ�2r��
r�����Դ��ǣ�2r�� ![]() r��
r��

 ��ĩ�óɼ�ϵ�д�
��ĩ�óɼ�ϵ�д� 99��1������ĩ��ѵ��ϵ�д�
99��1������ĩ��ѵ��ϵ�д� ��ǿ��У��ĩ���100��ϵ�д�
��ǿ��У��ĩ���100��ϵ�д� �óɼ�1��1��ĩ���100��ϵ�д�
�óɼ�1��1��ĩ���100��ϵ�д� ��״Ԫ���źþ�ϵ�д�
��״Ԫ���źþ�ϵ�д�