��Ŀ����
����Ŀ����ij�ϴ�ý[��Ҫ�ɷ�Ϊ����̿��ZnO��FeO����CH3COO��2Zn]����ȡ����п�����ʵ�鲽����ͼ��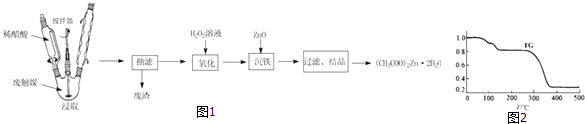
��1����ȡʱ����������ƿ�м���ϴ�ý��ϡ���ᣬ��������ƿ���Ȳ�ͬʱ������������Ŀ���� ��
��2�����Ƚ��ϴ�ý������¯��ͨ����500�洦��һ��ʱ�䣬�����ʻ�����ߣ���ԭ���� �� ����ʱ�õĹ��������������� ��
��3������ͼ�м���H2O2��Ŀ���� ��
��4�����þ��壨CH3COO��2Zn2H2O���ط�����TG/%=������Ʒ��ʣ������/������Ʒ����ʼ����������ͼ2�������ױ����ֽ�������Σ���200��C������ȥ�����ӽᾧˮ���γɵģ�CH3COO��2Zn��242��C���ڣ�370��C��ȫ�ֽ�ΪZnOͬʱ����CO2��һ�ֺ���������˴Ź�������ֻ��1��壩����CH3COO��2Zn�ֽ���������п�ķ�Ӧ����ʽΪ ��
���𰸡�
��1����߽�ȡ���ʺͽ�ȡ��
��2���������ڻ���̿���ڵĴ���пȫ���ͷų���������ƿ������©��
��3����Fe2+����ΪFe3+
��4��CH3COO��2Zn ![]() CH3COCH3+CO2��+ZnO
CH3COCH3+CO2��+ZnO
���������⣺�ϴ�ý�ô����ȡ��ZnO��FeO����ᷴӦ�ܽ⣬��CH3COO��2ZnҲ�ܽ⣬����̿����Ӧ�����˳�ȥ����̿�Ȳ��������ʣ�����������⽫Fe2+����ΪFe3+ �� �ټ���ZnO������ҺpH��ʹFe3+ת��Ϊ�����������������˳�ȥ����Һ�ᾧ�õ���CH3COO��2Zn����1�����Ȳ�ͬʱ������������Ŀ�ģ���߽�ȡ���ʺͽ�ȡ�ʣ����Դ��ǣ���߽�ȡ���ʺͽ�ȡ�ʣ���2����������̼��Ӧ���������ڻ���̿���ڵĴ���пȫ���ͷų����������ʻ�����ߣ�����ʱ�õĹ������������У�����ƿ������©�������Դ��ǣ��������ڻ���̿���ڵĴ���пȫ���ͷų���������ƿ������©������3��˫��ˮ���������ԣ��ܹ���Fe2+����ΪFe3+ �� �ټ���ZnO������ҺpH��ʹFe3+ת��Ϊ�����������������˳�ȥ�����Դ��ǣ���Fe2+����ΪFe3+����4����CH3COO��2Zn��370��C��ȫ�ֽ�ΪZnOͬʱ����CO2��һ�ֺ�����������������غ�֪������������Ļ�ѧʽΪC3H6O����Ϻ˴Ź�������ֻ��1��壬ֻ���DZ�ͪ��CH3COCH3������Ӧ����ʽΪ��CH3COO��2Zn ![]() CH3COCH3+CO2��+ZnO�����Դ��ǣ�CH3COO��2Zn
CH3COCH3+CO2��+ZnO�����Դ��ǣ�CH3COO��2Zn ![]() CH3COCH3+CO2��+ZnO��
CH3COCH3+CO2��+ZnO��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����������ṹ�����Ŀ��
��1���ù��ʾ��ͼ��ʾFe3+�ļ۵����Ų� ��
��2��ij����Ԫ�صĵ����ܣ����ӷ��أ����£�
I1 | I2 | I3 | I4 | I5 | I6 | I7 |
14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
�жϸ�Ԫ�ش����壻
��3����ABn������ԭ��A��û��δ�����γɹ��ۼ��ŶԵ��ӣ����ü۲���ӶԻ���ģ�ͣ�����˵����ȷ����������ĸ����
A.��n=2������ӵ����幹��ΪV��
B.��n=3������ӵ����幹��Ϊ������
C.��n=4������ӵ����幹��Ϊ����������
D.����˵��������ȷ
��4���������ӵĽṹ��ͼ1����V�ͣ�����116.5�㣮��ش𣺢ٳ����������Ĺ�ϵ�� ��
�����з�����������ӵĽṹ�����Ƶ���������ĸ����
A��H2O B��CO2 C��SO2 D��BeCl2
�۳��������Ƿ�Ϊ���Է�������ǡ�����
��5���ڶ�����Ԫ���У�������Ԫ����ɵļ������Ӽ����й��ۼ�����λ�����������������������������8���������ʵĵ���ʽ ��
��6��������Ϊ�������ܶѻ��ṹ������ѵ�ԭ�Ӱ뾶Ϊr�������ṹ��ͼ2��ʾ����þ����ı߳�a= �� b=���ú�r�Ĵ���ʽ��ʾ��
����Ŀ��������Ԫ��X��Y��Z��Ԫ�����ڱ��е�λ����ͼ��ʾ������YԪ��ԭ�ӵ������������ǵ��Ӳ������������ش��������⣺
X | ||
Y | Z |
��1��ZԪ����Ԫ�����ڱ��е�λ���� ��
��2��������֤��YԪ����ZԪ�صĵõ�������ǿ������ �� ������ţ�
A.�⻯��ˮ��Һ������
B.����������Ӧ��ˮ���������
C.��̬�⻯����ȶ���
D.���������ʱÿ��ԭ�ӵõ��ӵĶ���
��3���Ƚ�Y��Z�����Ӱ뾶��С�������ӷ��ű�ʾ��
��4��XԪ�ص�ij����̬�⻯������к���10�����ӣ��������ڼ����������ܹ���CuO��ԭΪCu��ͬʱ����һ�����壬�������ǿ����еijɷ�֮һ����Ӧ�Ļ�ѧ����ʽΪ �� ����Ӧ����6.02��1022�����ӷ���ת�ƣ�����g��CuO�μӷ�Ӧ��
����Ŀ���ҹ��Ǹ������������������Ϊ�����һ����¯��������Ϊ�ձ������������
��1��I����֪��Ӧ ![]() Fe2O3��s��+CO��g��
Fe2O3��s��+CO��g�� ![]() Fe��s��+CO2��g����H=��23.5kJmol��1 �� �÷�Ӧ��1000���ƽ�ⳣ������4����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol��Ӧ����l0min��ﵽƽ�⣮ ��CO��ƽ��ת����=
Fe��s��+CO2��g����H=��23.5kJmol��1 �� �÷�Ӧ��1000���ƽ�ⳣ������4����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol��Ӧ����l0min��ﵽƽ�⣮ ��CO��ƽ��ת����=
�������CO��ƽ��ת���ʣ��ٽ�Fe2O3��ת�����ɲ�ȡ�Ĵ�ʩ�� ��
a����߷�Ӧ�¶�
b������Ӧ��ϵ��ѹǿ
c��ѡȡ���ʵĴ���
d����ʱ���ջ��Ƴ�����CO2
e�������ʯ��ʹ����ƽ���������ֽӴ�
��2����¯���������ķ����е�CO�ɽ��л��գ�ʹ����һ�������º�H2��Ӧ�Ʊ��״���CO��g��+2H2��g��CH3OH��g���������ͼʾ�ش��������⣺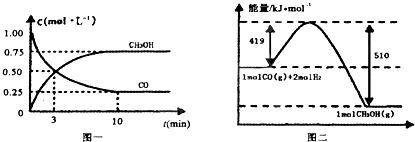
�ٴӷ�Ӧ��ʼ��ƽ�⣬��H2Ũ�ȱ仯��ʾƽ����Ӧ����v��H2��= ��
����֪������ȼ����286kJ/mol����д���״����岻���ȼ�յ��Ȼ�ѧ����ʽ ��
�������¶Ⱥ�������ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ�ⅼ���й��������±���
���� | ��Ӧ��Ͷ����� | ��Ӧ��� | CH3OH��Ũ�� | �����仯 |
�� | 1mol CO��2mol H2 | ��1 | c1 | �ų�Q1kJ���� |
�� | 1mol CH3OH | ��2 | c2 | ����Q2kJ���� |
�� | 2mol CO��4mol H2 | ��3 | c3 | �ų�Q3kJ���� |
�����й�ϵ��ȷ����
A��c1=c2B.2Q1=Q3C.2��1=��3D����1+��2=1E���÷�Ӧ������1mol CH3OH����ų���Q1+Q2��kJ������

