题目内容
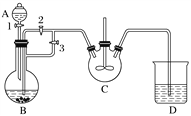
【题目】乳酸亚铁([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O―→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。已知FeCO3易被氧化:4FeCO3+6H2O+O2===4Fe(OH)3+4CO2。某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下:
回答下列问题:
(1)NH4HCO3盛放在装置__________(填字母)中,该装置中涉及的主要反应的离子方程式________________________________________________________________________。
(2)将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是____________________。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75 ℃下搅拌反应。铁粉的作用是________________________________________________________________________,反应结束后,无需过滤,除去过量铁粉的方法是_________________________________.
(4)经查阅文献后,该兴趣小组用铈(Ce)量法测定产品中Fe2+的含量。取2.880 g产品配成100 mL溶液,每次取20.00 mL,进行必要处理,用0.100 0 mol·L-1 Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2 19.70 mL。滴定反应如下:Ce4++Fe2+===Ce3++Fe3+,则产品中乳酸亚铁的质量分数为______________。
【答案】 C Fe2+ +2HCO===FeCO3↓+CO2↑+H2O (待D中导气管处的气体纯净后)关闭活塞3、打开活塞2 防止+2价的铁元素被氧化 加入适量乳酸让铁粉反应完全 98.50%
【解析】(1)装置B是铁和盐酸反应生成氯化亚铁,在装置C中氯化亚铁和碳酸氢铵反应生成碳酸亚铁,反应的离子方程式为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;(2)装置B中铁和盐酸反应生成氯化亚铁和氢气,先利用氢气排除装置C中的空气,防止碳酸亚铁被空气中的氧气氧化,待最后的导管口气体纯净后,关闭活塞3、打开活塞2,利用气体压强,将氯化亚铁溶液压入装置C中,与碳酸氢铵反应;(3)因为Fe2+易被氧化成Fe3+,加入铁粉,防止+2价的铁元素被氧化;铁粉过量时可以加入适量乳酸让铁粉反应完全;(4)根据反应Ce4++Fe2+===Ce3++Fe3+可知,亚铁离子的物质的量为0.1000 mol·L-1×0.01970L×5=0.00985mol,乳酸亚铁的质量分数=![]() =98.50%。
=98.50%。

【题目】如图利用培养皿探究氨气的性质,实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面。下表中对实验现象的描述及所做的解释均正确的是
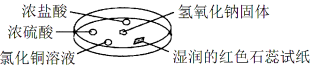
选项 | 实 验 现 象 | 解 释 |
A | 浓盐酸附近产生白烟 | NH3与HCl反应生成了NH4Cl固体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化铜溶液变白色浑浊 | 白色浑浊的成分是Cu(OH)2 |
D | 湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
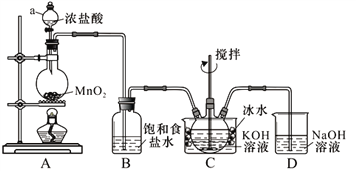
【题目】某兴趣小组用下图所示装置制备气体(酒精灯可以根据需要选择),对应说法正确的是

选项 | ①中药品 | ②中药品 | ③中药品 | ④中药品 | 制备气体 | ⑥中药品及作用 |
A | 浓盐酸 | MnO2 | 饱和食盐水 | 浓硫酸 | C12 | NaOH溶液,尾气吸收 |
B | 稀硝酸 | Cu | 烧碱溶液 | 浓硫酸 | NO | Na()H溶液,尾气吸收 |
C | 浓盐酸 | 大理石 | 饱和Na2CO3溶液 | 浓硫酸 | CO2 | 澄清石灰水,检验CO2 |
D | 浓盐酸 | Zn | 水 | 浓硫酸 | H2 | 可撤去 |
A. A B. B C. C D. D