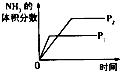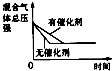题目内容
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
(1)则25℃时水的电离平衡曲线应为(填“A”或“B”),请说明理由
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 .
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 .
(4)曲线B对应温度下,pH=2的HCl溶液和pH=10的某BOH溶液等体积混合后,混合溶液的pH=8.请分析其原因: .
【答案】
(1)A;温度越高Kw越大
(2)10:1
(3)pH1+pH2=14
(4)BOH为弱碱,c(BOH)?c(HCl),等体积混合两溶液时,BOH过量,混合溶液呈碱性
【解析】解:(1)纯水中,水的电离是吸热反应,升高温度促进水电离,c(OH﹣)、c(H+)增大且c(OH﹣)=c(H+),水的离子积常数增大,所以25℃时水的电离平衡曲线应为A,所以答案是:A;温度越高Kw越大;(2)25℃时,将pH=9的NaOH溶液中C(OH﹣)=10﹣5 mol/L,pH=4的H2SO4溶液中C(H+)=10﹣4 mol/L,要使混合溶液呈中性,则氢氧根离子的物质的量等于氢离子的物质的量,设碱的体积为xL,酸的体积为yL,则10﹣5 mol/L×xL=10﹣4 mol/L×yL,所以x:y=10﹣4:10﹣5=10:1,所以答案是:10:1;(3)99℃时,pH1=a的某强酸溶液中C(H+)=10﹣a mol/L,pH2=b的某强碱溶液C(OH﹣)=10b﹣12 mol/L,溶液呈中性,则酸中氢离子的物质的量应等于碱中氢氧根离子的物质的量,所以100×10﹣a=1×10b﹣12 , a+b=14,即pH1+pH2=14,所以答案是:pH1+pH2=14;(4)曲线B对应温度下,pH=2的盐酸溶液和pH=10的某BOH溶液等体积混合后,氢离子和氢氧根离子恰好反应,如果碱是强碱,则盐溶液呈中性,实际上溶液呈碱性,则碱为弱碱,生成强酸弱碱盐水解呈碱性,中和后混合溶液中还剩余较多的弱碱分子,可继续电离出OH﹣ , 使溶液呈碱性,所以答案是:BOH为弱碱,c(BOH)c(HCl),等体积混合两溶液时,BOH过量,反应后溶液呈碱性.

 名校课堂系列答案
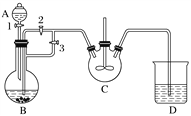
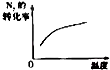
名校课堂系列答案【题目】对于可逆反应N2(g)+3H2(g)2NH3(g)△H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A.A
B.B
C.C
D.D