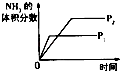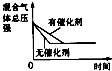题目内容
【题目】在298K,1.01×105Pa下,将22g CO2通入750mL 1molL﹣1 NaOH的溶液中充分反应,测得反应放出x kJ的热量.已知在该条件下,1mol CO2通入1L 2molL﹣1 NaOH溶液中充分反应放出y kJ的热量.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
A.CO2(g)+NaOH(aq)═NaHCO3(aq)△H=﹣(2y﹣x)kJmol﹣1
B.CO2(g)+NaOH(aq)═NaHCO3(aq)△H=﹣(4x﹣y)kJmol﹣1
C.CO2(g)+NaOH(aq)═NaHCO3(aq)△H=﹣(2x﹣y)kJmol﹣1
D.2CO2(g)+2NaOH(l)═2NaHCO3(l)△H=﹣(8x﹣2y)kJmol﹣1
【答案】B
【解析】解:根据题意,22gCO2通入1molL﹣1NaOH溶液750mL中充分反应,n(CO2)= ![]() =0.5mol,n(NaOH)=1molL﹣1×0.75L=0.75mol, 该反应既生成碳酸钠又生成碳酸氢钠,方程式为2CO2+3NaOH═NaHCO3+Na2CO3+H2O,
=0.5mol,n(NaOH)=1molL﹣1×0.75L=0.75mol, 该反应既生成碳酸钠又生成碳酸氢钠,方程式为2CO2+3NaOH═NaHCO3+Na2CO3+H2O,
由0.5molCO2反应放出热量为xKJ,则2molCO2反应放出热量为4xKJ,即热化学反应方程式为
2CO2(g)+3NaOH(aq)═NaHCO3 (aq)+Na2CO3(aq)+H2O(l)△H=﹣4xKJ/mol①,
又1mol CO2通入2molL﹣1NaOH溶液1L中充分反应放出y kJ的热量,则热化学方程式为
2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l)△H=﹣yKJ/mol②,
由盖斯定律可知,①﹣②可得,NaOH(aq)+CO2(g)═NaHCO3(aq)△H=﹣(4x﹣y)KJ/mol,
故选B.

 一诺书业暑假作业快乐假期云南美术出版社系列答案
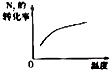
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】对于可逆反应N2(g)+3H2(g)2NH3(g)△H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A.A
B.B
C.C
D.D