题目内容
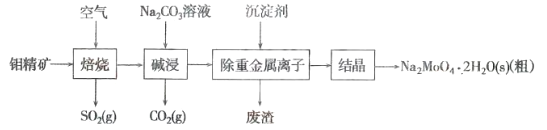
【题目】如下图所示,利用海水可提取很多重要的化工原料。
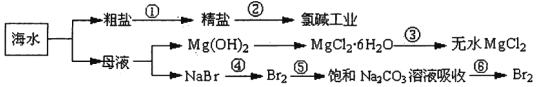
下列有关说法正确的是.( )。
A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.第②步中工业上可采用石墨为阴极,铁为阳极,采用阳离子交换膜的电解装置
C.第③步中结晶出的MgCl2·6H2O可在空气中受热分解制无水MgCl2
D.在第④步中溴元素被氧化,第⑤、⑥步中既有溴元素被氧化也有溴元素被还原
【答案】D
【解析】
A、第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品的顺序应保证Na2CO3在BaCl2之后,除去过量的钡离子,可以为: NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸,A错误;
B、氯碱工业中,电解池阳极材料也是惰性的,B错误;
C、由③的转化可知,结晶水合物失去结晶水并生成氯化镁,为防止镁离子水解,应在氯化氢的氛围下进行,C错误;
D、由④可知NaBr→Br2,溴元素的化合价升高,被氧化,第⑤、⑥步是溴的提纯,既有溴元素被氧化也有溴元素被还原,D正确。
答案选D。

 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
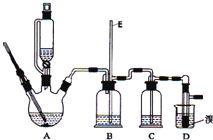
高效智能课时作业系列答案【题目】实验室用少量的溴和足量的乙醇制备1,![]() 二溴乙烷的装置如图所示:
二溴乙烷的装置如图所示:
提示:乙醇与浓硫酸在![]() 时脱水生成乙醚,在
时脱水生成乙醚,在![]() 时脱水生成乙烯.有关数据列表如下:
时脱水生成乙烯.有关数据列表如下:
乙醇 | 1, | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度 | 0.79 | 2.2 | 0.71 |
沸点 | 78.5 | 132 | 34.6 |
熔点 | -130 | 9 | -116 |
回答下列问题:
![]() 装置D中发生主要反应的化学方程式为 ______
装置D中发生主要反应的化学方程式为 ______
![]() 装置B的作用 ______ ,长玻璃管E的作用 ______
装置B的作用 ______ ,长玻璃管E的作用 ______
![]() 在装置C中应加入 ______ ,其目的是吸收反应中可能生成的酸性气体
在装置C中应加入 ______ ,其目的是吸收反应中可能生成的酸性气体![]() 填正确选项前的字母
填正确选项前的字母![]()
![]() 水
水![]() 浓硫酸
浓硫酸![]() 氢氧化钠溶液
氢氧化钠溶液![]() 饱和碳酸氢钠溶液
饱和碳酸氢钠溶液
![]() 反应过程中应用冷水冷却装置D,其主要目的是 ______ ;但又不能过度冷却
反应过程中应用冷水冷却装置D,其主要目的是 ______ ;但又不能过度冷却![]() 如用冰水
如用冰水![]() ,其原因是 ______ ;将1,
,其原因是 ______ ;将1,![]() 二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 ______ 层
二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 ______ 层![]() 填“上”、“下”
填“上”、“下”![]()
![]() 若产物中有少量未反应的
若产物中有少量未反应的![]() ,最好用 ______ 洗涤除去
,最好用 ______ 洗涤除去![]() 填正确选项前的字母
填正确选项前的字母![]()
![]() 水
水![]() 氢氧化钠溶液
氢氧化钠溶液![]() 碘化钠溶液
碘化钠溶液![]() 乙醇
乙醇
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化