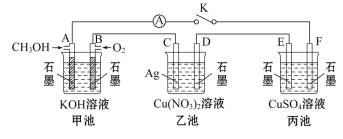
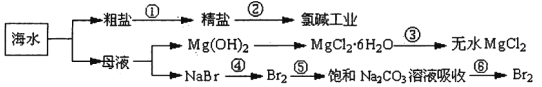
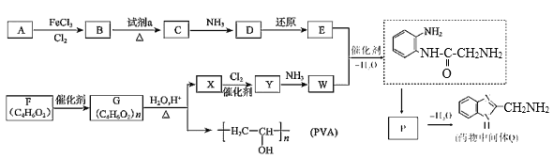
题目内容
【题目】氰![]() 的化学性质与卤素
的化学性质与卤素![]() 很相似,化学上称之为拟卤素,其氧化性介于
很相似,化学上称之为拟卤素,其氧化性介于![]() 和
和![]() 之间,下列有关反应方程式正确的是
之间,下列有关反应方程式正确的是
A.![]() 和KCN溶液之间不发生反应
和KCN溶液之间不发生反应
B.向KCN溶液中加入碘水:![]()
![]()
![]()
C.![]() 和HCN反应:
和HCN反应:![]() 浓
浓![]()
![]()
![]()
D.在NaI和KCl混合溶液中通入少量![]() :
:![]()
【答案】C
【解析】
氰![]() 的化学性质与卤素
的化学性质与卤素![]() 很相似,
很相似,![]() 和水反应可生成HCN和HCNO;
和水反应可生成HCN和HCNO;![]() 的氧化性比
的氧化性比![]() 弱,比
弱,比![]() 强,据此来分析即可。
强,据此来分析即可。
A.氰的氧化性介于![]() 和
和![]() 之间,
之间,![]() 和KCN溶液之间可发生反应生成
和KCN溶液之间可发生反应生成![]() 和KBr,故A错误;
和KBr,故A错误;
B.向KCN溶液中加入碘水,![]() 的氧化性比
的氧化性比![]() 强:不能发生反应
强:不能发生反应![]() ,故B错误;
,故B错误;
C.![]() 和HCN反应可以类推二氧化锰和浓盐酸的反应,所以反应的化学方程式为:
和HCN反应可以类推二氧化锰和浓盐酸的反应,所以反应的化学方程式为:![]() ,故C正确;
,故C正确;
D.在NaI和KCl混合溶液中通入少量![]() ,只能氧化碘离子,离子方程式为
,只能氧化碘离子,离子方程式为![]() ,故D错误;
,故D错误;
答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ: |
② | 0 | 0 | 2 | 吸收热量:Q |
实验还测得到达平衡后,两容器中相同组分的质量分数(或体积分数)都相同。下列叙述正确的是( )
A.容器①、②中反应的平衡常数不相等
B.平衡时,两个容器中NH3的体积分数均为1/7
C.平衡时,两个容器中反应物的转化率之和等于1
D.容器②中达平衡时吸收的热量Q=23.15kJ