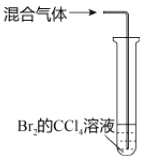
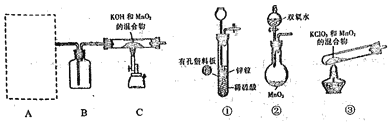
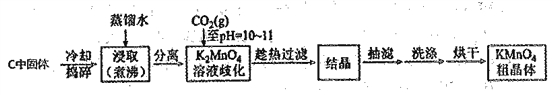
��Ŀ����
����Ŀ����֪NaHSO4��ˮ�еĵ��뷽��ʽΪ��NaHSO4��Na����H����SO42����ij�¶��£���pH��6������ˮ�м���NaHSO4���壬�����¶Ȳ��䣬�����Һ��pHΪ2�����жԸ���Һ�������У�����ȷ���ǣ� ��
A. ���¶ȸ���25��
B. ��ˮ���������H����Ũ����1.0��10��10mol��L��1
C. NaHSO4����ļ���������ˮ�ĵ���
D. ���¶��¼�������pHΪ12��NaOH��Һ��ʹ����Һǡ�ó�����
���𰸡�D
��������A����ˮ��pH=6��˵��c��H+��=c��OH����=1��10��6molL��1��Kw=1��10��12��1��10��14��˵���¶ȸ���25������A��ȷ��
B��ˮ��������������ӵ�Ũ�ȵ�����Һ����������Ũ�ȣ�c��H+��=c��OH����=![]() =
=![]() =1��10��10molL��1����B��ȷ��
=1��10��10molL��1����B��ȷ��
C��NaHSO4����������������ӣ��൱��һԪǿ�ᣬ������ˮ�ĵ��룬��C��ȷ��
D��Kw=1��10��12��Ӧ��������Ũ��Ϊ0.01molL��1������������Һ����Ӧ��������pH=10��NaOH��Һ����ʹ����Һǡ�ó����ԣ���D����ѡD��

 ��һ������Ԫͬ�����ؾ�ϵ�д�
��һ������Ԫͬ�����ؾ�ϵ�д�����Ŀ������ʵ�鷽���У��ܴﵽ��Ӧʵ��Ŀ�ĵ���
ʵ�鷽�� |
|
|
|
|
Ŀ�� | A���Ƚ��Ҵ��������ǻ���ԭ�Ӻ�ˮ��������ԭ�ӵĻ����� | B����ȥ��ϩ�еĶ������� | C����������Һ | D��֤��̼������ǿ�ڱ��� |
A. A B. B C. C D. D
����Ŀ������ʵ������ܴﵽʵ��Ŀ�ĵ���(����)
��� | ʵ����� | ʵ��Ŀ�� |
�� | �μ����Ը��������Һ | ȷ�����л�����ȩ |
�� | ��ˮ����������Һ��ֱ�Ӽ�������������ͭ����Һ������ | ȷ�������Ƿ�ˮ�� |
�� | ����̼��������Һ | ȷ���Ҵ��л������� |
�� | �ӵ��� | ȷ��ʳ���к��е���� |
A. �٢� B. �ڢ� C. �٢� D. �ڢ�