题目内容
在0.1 mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH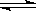 CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
B
解析试题分析:醋酸为弱电解质,加入水可以促进其水解,所以加入水时,平衡向逆反应方向移动,故A错误;加入少量NaOH固体,中和掉氢离子,所以平衡向正反应方向移动,故B正确;加入少量0.1 mol·L-1 HCl溶液,溶液中的氢离子变大,所以平衡向左移动,但是根据勒夏特勒原理可以知道,溶液中的c(H+)比原来还是增大了,故C错误;加入少量CH3COONa固体,产生了醋酸根离子,所以平衡向逆反应方向移动,故D错误。
考点:电离平衡
点评:本题考查了电离平衡,该知识点是高考考查的重点,本题要掌握加入水、加热促进弱电解质的电离,加酸抑制弱酸的电离,加入与弱电解质电离出相同离子的电解质抑制电离,该题难度适中。

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目