题目内容
19.某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题:
(1)装置A是用来制取氯气的,若烧瓶中盛放的是漂白粉,分液漏斗中是盐酸,
①配平该反应的化学方程式:
1Ca(ClO)2+4HCl═2Cl2↑+1CaCl2+2H2O
②装置A中g管的作用是平衡压强,使稀硫酸能顺利地滴入烧瓶中.
(2)装置D中放有一块红色的纸条,一半用水润湿,一半干燥.实验过程中发现,湿润的部分很快褪色了,又过了一段时间,整块纸条全部褪色.某同学认为是因为装置D中下半部分氯气浓度大于上半部分,这种解释是否合理?不合理(填“合理”或“不合理”),若不合理请说明真正的原因:实验进行中氯气与湿润纸条中的水生成HClO,使纸条湿润部分褪色,干燥的部分无水,不能生成HClO所以不褪色,但过一段时间后由于水分子运动,整个纸条都变得湿润,所以就全部褪色了(若填合理则此空不答).
(3)反应一段时间后用注射器从E中抽取少量溶液,检验出有Fe3+生成,请写出该反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-
(4)已知HCO3-的酸性弱于次氯酸,写出少量的氯气与F中足量的碳酸钠溶液反应的化学方程式:Cl2+2Na2CO3+H2O=NaCl+NaClO+2NaHCO3,
反应一段时间后停止反应(此时F中还有碳酸钠剩余),得到355g含氯元素10%的“漂白液”,则理论上该“漂白液”中有效成分的物质的量为0.5mol.
分析 (1)①分析反应中元素化合价变化,依据氧化还原反应得失电子守恒、原子个数守恒书写方程式;
②导气管将分液漏斗与圆底烧瓶相连,使二者内部压强相等;
(2)根据氯气不能使红色物质褪色,HClO使有色的物质褪色及水分子的运动来分析;
(3)氯气具有强的氧化性能够氧化二价铁离子生成三价铁;
(4)将少量的氯气通入到过量的碳酸钠溶液中,氯气和水反应生成的盐酸反应生成碳酸氢钠,次氯酸酸性强于碳酸氢根离子,反应生成碳酸氢钠;
氯元素含量为10%的漂水溶液355g,则m(Cl)=35.5g,n(Cl)=1mol,再利用n(Cl)=n(NaCl)+n(NaClO)及Cl2+2NaOH═NaCl+NaClO+H2O来分析.
解答 解:(1)①由题意知道:次氯酸钙中氯元素从+1价降为氯气中的0价,1mol次氯酸钙反应得到2mol电子,氯化氢中-1价的氯升高为氯气中0价,1mol氯化氢参加反应失去1mol电子,要使氧化剂与还原剂得失电子守恒,则次氯酸钙系数为1,氯化氢系数为2,依据原子个数守恒,反应方程式:Ca(ClO)2 +4HCl=CaCl2 +2Cl2↑+2 H2O;
故答案为:1;4HCl;2;1;2H2O;
②导气管将分液漏斗与圆底烧瓶相连,使二者内部压强相等,有利于稀硫酸顺利的滴入烧瓶中;
故答案为:平衡压强,使稀硫酸能顺利地滴入烧瓶中;
(2)实验进行中氯气与湿润纸条中的水生成HClO,使纸条湿润部分褪色,干燥的部分无水,不能生成HClO所以不褪色,但过一段时间后由于水分子运动,整个纸条都变得湿润,所以就全部褪色了;
故答案为:不合理;实验进行中Cl2与湿润红色纸条中的水反应生成HClO使湿润的红色纸条褪色,干燥部分没有HClO,所以纸条不褪色,放置一段时间,由于水分子运动会导致整个纸条湿润而褪色;
(3)氯气与二价铁离子反应生成三价铁离子与氯离子,离子方程式:2Fe2++Cl2=2Fe3++2Cl-;
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)将少量的氯气通入到过量的碳酸钠溶液中,氯气和水反应生成的盐酸反应生成碳酸氢钠,次氯酸酸性强于碳酸氢根离子,反应生成碳酸氢钠,化学方程式:Cl2+2Na2CO3+H2O=NaCl+NaClO+2NaHCO3;
氯元素含量为10%的漂水溶液355g,则m(Cl)=×10%=35.5g,n(Cl)=$\frac{35.5g}{35.5g/mol}$=1mol,
由Cl2+2NaOH═NaCl+NaClO+H2O可知,
n(Cl)=n(NaCl)+n(NaClO),则n(NaClO)=$\frac{1mol}{2}$=0.5mol;
故答案为:Cl2+2Na2CO3+H2O=NaCl+NaClO+2NaHCO3;0.5.
点评 本题考查氯气的制取实验装置及氯气的性质,明确装置的作用及装置中发生的化学反应即可解答,难度不大.

| A. | 1:4 | B. | 1:5 | C. | 2:5 | D. | 1:7 |
| A. | 二氧化硫可广泛用于食品的增白 | |
| B. | 能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2 | |
| C. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
| A. | H2SO4的摩尔质量是98 | |
| B. | 2 mol NO和2 mol N2含原子数相同 | |
| C. | 等质量的O2和O3中所含氧原子个数相同 | |
| D. | 等物质的量的CO和CO2中所含碳原子数相等 |
| A. | Ba(OH)2═Ba2++2OH- | B. | H2SO4═2H++SO42- | ||
| C. | NaHCO3═Na++H++CO3- | D. | NaCl═Na++Cl- |
| A. | 平衡后充入氦气,平衡正向移动 | |
| B. | 以X浓度变化表示反应速率:v(X)=0.001 mol/(L•s) | |
| C. | 平衡后升高温度Y的转化率减小,则正反应为吸热反应 | |
| D. | 达到平衡时,X与Y 的浓度相等 |
| A. | 乙烯的结构式:CHCH | |
| B. | 氯离子的结构示意图: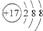 | |
| C. | NH4Cl的电子式: | |
| D. | 碳酸氢钠的电离方程式:NaHCO3═Na++H++CO32- |
| A. | 两个电极均为铁片,M是阴极,电解液是0.4%的NaOH溶液 | |
| B. | 两个电极均为石墨,M是阳极,电解液是0.4%的H2SO4溶液 | |
| C. | 两个电极均为石墨,M是阳极,电解液是0.4%的KOH溶液 | |
| D. | M是铁片,N是石墨,M是阴极,电解液是0.4%的KNO3溶液 |