题目内容
20.随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图1所示.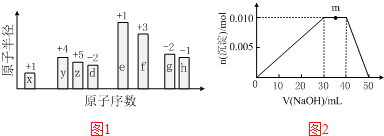
根据判断出的元素回答问题:
(1)f在元素周期表的位置是第三周期ⅢA族.
(2)比较d、e常见离子的半径的小(用化学式表示,下同)O2->Na+;比较g、h的最高价氧化物对应的水化物的酸性强弱是:HClO4>H2SO4.
(3)任选上述元素组成一种四原子共价化合物,写出其电子式
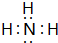 (或
(或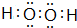
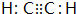 ).
).(4)已知1mol 单质e在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1.
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol•L?1R溶液的烧杯中滴加1mol•L?1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图2如下:
①写出m点反应的离子方程式NH4++OH-=NH3•H2O.
②若R溶液改加20mL1.2mol•L?1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为0.022mol.
分析 从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)f是Al元素,在元素周期表的位置是第三周期ⅢA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小;非金属性越强,最高价氧化物水化物的酸性越强;
(3)四原子共价化合物,可以是NH3、H2O2、C2H2等;
(4)1molNa的单质在足量O2中燃烧生成Na2O2(s),放出255.5kJ热量,2molNa反应放出热量为511kJ,注明聚集状态、反应热书写热化学方程式;
(5)①R是NH4Al(SO4)2,m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3•H2O;
②根据n=cV计算n(Al3+ )、n(NH4+)、n(SO42-)、n(Ba2+)、n(OH-),根据SO42-、Ba2+中不足量的离子的物质的量计算生成BaSO4的物质的量,依次发生:Al3++3OH-=Al(OH)3↓、NH4++OH-=NH3•H2O、Al(OH)3+OH-=AlO2-+2H2O,根据方程式计算生成Al(OH)3的物质的量,进而二者计算生成固体总物质的量.
解答 解:从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)f是Al元素,在元素周期表的位置是第三周期ⅢA族,故答案为:第三周期ⅢA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(O2-)>r(Na+);非金属性越强,最高价氧化物水化物的酸性越强,故酸性:HClO4>H2SO4,
故答案为:r(O2-)>r(Na+);HClO4;H2SO4;
(3)四原子共价化合物,可以是NH3、H2O2、C2H2等,其电子式为: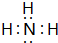 (或
(或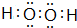
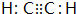 ),
),
故答案为: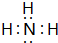 (或
(或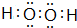
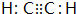 );
);
(4)1molNa的单质在足量O2中燃烧生成Na2O2(s),放出255.5kJ热量,2molNa反应放出热量为511kJ,则该反应的热化学方程式为:2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1,
故答案为:2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1;
(5)①R是NH4Al(SO4)2,m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3•H2O,离子方程式为:NH4++OH-=NH3•H2O,
故答案为:NH4++OH-=NH3•H2O;
③10mL 1mol•L-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.2 mol•L-1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH-为0.048mol,
由SO42-+Ba2+=BaSO4↓,可知SO42-不足,故可以得到0.02mol BaSO4,
Al3++3OH-=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反应剩余OH-为0.048mol-0.03mol=0.018mol,
NH4++OH-=NH3•H2O
0.01mol 0.01mol
反应剩余OH-为0.018mol-0.01mol=0.008mol,
Al(OH)3+OH-=AlO2-+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀为0.01mol-0.008mol=0.002mol
则最终得到固体为0.02mol+0.002mol=0.022mol,
故答案为:0.022.
点评 本题考查结构位置性质关系、离子半径的大小比较、元素周期律、热化学方程式书写、化学图象及化学计算,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案| A. | Al3+、Al、Mg、K | B. | S、Cl、Cl-、S2- | C. | Na+、Na、Cl、Cl- | D. | Ca2+、K+、S2-、Cl- |
| A. | 减少少量W,逆反应速率减小 | |
| B. | 当容器中气体的平均相对分子质量不变时,反应达到平衡 | |
| C. | 降低温度,平衡正向移动 | |
| D. | 平衡后加入Z,上述反应的△H减小 |
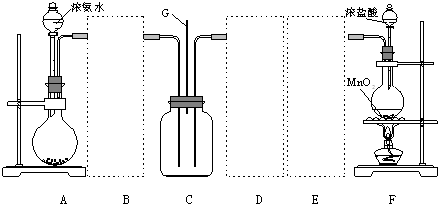
| Ⅰ | Ⅱ | Ⅲ | |
| 备选 装置 |  | 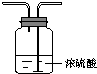 | 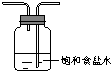 |
(1)装置A中烧瓶内的固体可选用a、b.
a.烧碱 b.生石灰c.二氧化硅 d.五氧化二磷
(2)往装置A的烧瓶内加入粉末状固体的操作方法是:将烧瓶横放,将盛有药品药匙或小纸槽伸入瓶底,再将烧瓶竖起.
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择并将编号填入下列空格.
B碱石灰;E饱和食盐水(填编号).
(4)装置C内出现白烟并在容器内壁凝结,鉴定该固体是氯化铵所需要的试剂和试纸除蒸馏水外还有NaOH溶液和湿润的红色石蕊试纸;硝酸银溶液和稀硝酸.
(5)如果C中气体未出现红棕色,写出C中发生反应的化学方程式8NH3+3Cl2=6NH4Cl+N2.
| A. | 1:4 | B. | 1:5 | C. | 2:5 | D. | 1:7 |
| A. | 二氧化硫可广泛用于食品的增白 | |
| B. | 能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2 | |
| C. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
