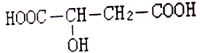题目内容
【题目】锂的某些化合物是性能优异的材料。请回答:
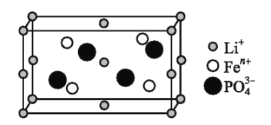
(1)如图是某电动汽车电池正极材料的晶胞结构示意图,其化学式为 ______ ,其中![]() 的基态电子排布式为 ______ ,
的基态电子排布式为 ______ ,![]() 的空间构型为 ______ 。
的空间构型为 ______ 。
(2)![]() 与Na中第一电离能较小的元素是 ______ ;LiF与NaCl晶体中熔点较高的是 ______ 。
与Na中第一电离能较小的元素是 ______ ;LiF与NaCl晶体中熔点较高的是 ______ 。
(3)氮化锂是一种良好的储氢材料,其在氢气中加热时可吸收氢气得到氨基锂![]() 和氢化锂,氢化锂的电子式为 ______ ,上述反应的化学方程式为 ______。
和氢化锂,氢化锂的电子式为 ______ ,上述反应的化学方程式为 ______。
(4)金属锂为体心立方晶胞,其配位数为 ______ ;若其晶胞边长为apm,则锂晶体中原子的空间占有率是 ______ 。
(5)有机锂试剂在有机合成中有重要应用,但极易与![]() 、
、![]() 等反应.下列说法不正确的是 ______
等反应.下列说法不正确的是 ______ ![]() 填字母序号
填字母序号![]() 。
。
A.CO2中σ键与π键的数目比为1:1
B.游离态和化合态锂元素均可由特征发射光谱检出
C.叔丁基锂(C4H9Li)中碳原子的杂化轨道类型为sp3和sp2。
【答案】![]()
![]() 正四面体 Na LiF
正四面体 Na LiF ![]() :
:![]()
![]() 8
8 ![]() C
C
【解析】
![]() 对于平行六面体晶胞而言,用均摊法计算的依据是:①处于顶点的微粒,同时为8个晶胞所共用,每个微粒有1/8属于该晶胞;②处于棱上的微粒,同时为4个晶胞所共用,每个微粒有1/4属于该晶胞;③处于面上的微粒,同时为2个晶胞所共用,每个微粒有1/2属于该晶胞;④处于晶胞内部的微粒,完全属于该晶胞,据此分析解答;价层电子对数=
对于平行六面体晶胞而言,用均摊法计算的依据是:①处于顶点的微粒,同时为8个晶胞所共用,每个微粒有1/8属于该晶胞;②处于棱上的微粒,同时为4个晶胞所共用,每个微粒有1/4属于该晶胞;③处于面上的微粒,同时为2个晶胞所共用,每个微粒有1/2属于该晶胞;④处于晶胞内部的微粒,完全属于该晶胞,据此分析解答;价层电子对数=![]() 键电子对数+孤电子对数,孤电子对数
键电子对数+孤电子对数,孤电子对数![]() ,(其中a为中心原子的价电子数,x为与中心原子结合的原子个数,b为与中心原子结合的原子最多接受的电子数),根据价层电子互斥理论即可得出空间构型,据此分析作答;
,(其中a为中心原子的价电子数,x为与中心原子结合的原子个数,b为与中心原子结合的原子最多接受的电子数),根据价层电子互斥理论即可得出空间构型,据此分析作答;
![]() 同一主族自上而下第一电离能逐渐减小;离子晶体的熔沸点由晶格能的大小决定,而离子晶体的晶格能则由离子所带电荷和离子半径共同决定。电荷多、半径小的离子晶体晶格能大,熔沸点高,据此分析;
同一主族自上而下第一电离能逐渐减小;离子晶体的熔沸点由晶格能的大小决定,而离子晶体的晶格能则由离子所带电荷和离子半径共同决定。电荷多、半径小的离子晶体晶格能大,熔沸点高,据此分析;
![]() 氢化锂属于离子化合物,据此写出电子式;陌生方程式的书写根据题干信息确定反应物和生成物,然后配平即可;
氢化锂属于离子化合物,据此写出电子式;陌生方程式的书写根据题干信息确定反应物和生成物,然后配平即可;
![]() 体心立方晶胞的晶体,配位数为8;晶胞体对角线长度为原子半径的4倍,晶胞体对角线长度为晶胞棱长的
体心立方晶胞的晶体,配位数为8;晶胞体对角线长度为原子半径的4倍,晶胞体对角线长度为晶胞棱长的![]() 倍,原子的空间占有率为原子所占体积除以晶胞的体积,据此解答;
倍,原子的空间占有率为原子所占体积除以晶胞的体积,据此解答;
![]() 双键含有1个
双键含有1个![]() 键、1个
键、1个![]() 键,而一个二氧化碳分子含二个双键,据此作答;每种原子都有自己的特征谱线,游离态和化合态均可由特征发射光谱检出,据此作答;叔丁基锂(C4H9Li) 中碳原子的杂化方式可类比有机C原子的杂化方式,有机物中C原子的杂化方式规律为:单键C原子为SP3杂化,一个双键为SP2杂化,一个叁键为SP杂化,据此作答;
键,而一个二氧化碳分子含二个双键,据此作答;每种原子都有自己的特征谱线,游离态和化合态均可由特征发射光谱检出,据此作答;叔丁基锂(C4H9Li) 中碳原子的杂化方式可类比有机C原子的杂化方式,有机物中C原子的杂化方式规律为:单键C原子为SP3杂化,一个双键为SP2杂化,一个叁键为SP杂化,据此作答;
![]() 根据均摊法可知,晶胞中
根据均摊法可知,晶胞中![]() 数目为
数目为![]() ,
,![]() 数目为4,
数目为4,![]() 离子数目为4,根据化合价代数和为0,可知
离子数目为4,根据化合价代数和为0,可知![]() ,故化学式为:
,故化学式为:![]() ,
,![]() 的核外电子排布式为
的核外电子排布式为![]() ,
,![]() 中P原子孤电子对数
中P原子孤电子对数![]() ,价层电子对数
,价层电子对数![]() ,空间构型为正四面体;
,空间构型为正四面体;
故答案为:![]() ;
;![]() ;正四面体;
;正四面体;
![]() 同主族自上而下第一电离能减小,故第一电离能
同主族自上而下第一电离能减小,故第一电离能![]() ,离子所带电荷相同,离子半径
,离子所带电荷相同,离子半径![]() 、
、![]() ,故LiF的晶格能大于NaCl的,故LiF的沸点较高;
,故LiF的晶格能大于NaCl的,故LiF的沸点较高;
故答案为:Na;LiF;
![]() 氢化锂属于离子化合物,由锂离子与氢负离子构成,电子式为
氢化锂属于离子化合物,由锂离子与氢负离子构成,电子式为![]() :
:![]() ,氮化锂在氢气中加热时可吸收氢气得到氨基锂
,氮化锂在氢气中加热时可吸收氢气得到氨基锂![]() 和氢化锂,反应方程式为:
和氢化锂,反应方程式为:![]() ;
;
故答案为:![]() :
:![]() ;
;![]() ;
;
![]() 金属锂为体心立方晶胞,体心Li原子与晶胞顶点Li原子相邻,则配位数为8;晶胞中Li原子数目为
金属锂为体心立方晶胞,体心Li原子与晶胞顶点Li原子相邻,则配位数为8;晶胞中Li原子数目为![]() ,晶胞体对角线长度为Li原子半径的4倍,晶胞体对角线长度为晶胞棱长的
,晶胞体对角线长度为Li原子半径的4倍,晶胞体对角线长度为晶胞棱长的![]() 倍,设Li原子半径为r,则晶胞棱长为
倍,设Li原子半径为r,则晶胞棱长为![]() ,故原子的空间占有率
,故原子的空间占有率 ;
;
故答案为:![]() ;
;
![]() 的结构式为
的结构式为![]() ,单键为
,单键为![]() 键,双键含有1个
键,双键含有1个![]() 键、1个
键、1个![]() 键,
键,![]() 键与
键与![]() 键的数目比为1:1 ;故A正确;
键的数目比为1:1 ;故A正确;
B.每种原子都有自己的特征谱线,游离态和化合态锂元素均可由特征发射光谱检出,故B正确;
C.叔丁基锂![]() 中碳原子的杂化轨道数目均为4,碳原子采取
中碳原子的杂化轨道数目均为4,碳原子采取![]() 杂化,故C错误;
杂化,故C错误;
故选:C;

【题目】实验室从含碘废液(含有H2O 、CCl4、I2、I-等)中回收碘,操作过程如下:
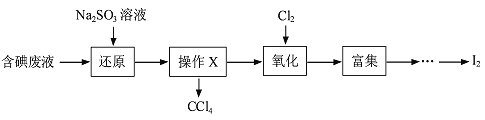
(1)向废液中加入Na2SO3溶液,发生“还原”反应的离子方程式为____________。
(2)“氧化”操作在三颈烧瓶中进行(如图一),将溶液用盐酸调至pH约为2,缓慢通入Cl2。实验用水浴控制在40℃左右的较低温度下进行的原因是_______。
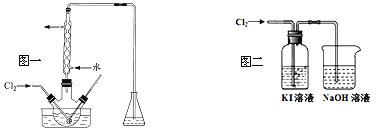
(3)某研究小组用图二装置对Cl2与KI溶液的反应进行探究,发现通入Cl2一段时间后,KI溶液变为黄色,继续通入Cl2,则溶液黄色变浅,最后变为无色。研究小组对所得无色溶液中碘元素的存在形态提出了以下假设:
假设一:没有I2形态;假设二:没有I-形态;假设三:有IO3-形态。
①请设计实验证明假设一成立(试剂自选)。
实验操作 | 预期现象 | 结论 |
___________________ | 假设一成立 |
②若假设三成立,请写出生成IO3-的离子方程式__________________________________。
(4)该研究小组还进行了对加碘盐中KIO3含量测定的如下实验:
①准确称取加碘盐m g于烧杯中,加入适量蒸馏水和过量的KI,再滴入适量的稀硫酸,充分反应,将所得混合液配成250.00mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉试液,用c molL-1Na2S2O3标准液滴定至终点,重复3次,测得平均值为V mL。
已知:IO3-+ 5I-+6H+ =3H2O+3I2,I2 +2S2O32-=2I-+S4O62-。测定时,判断达到滴定终点的现象为___________。由测定数据可求得该样品中含KIO3的质量分数为___________(用含m、c、V的代数式表示,Mr(KIO3)=214 )。
②在滴定操作正确无误的情况下,用此种测定方法测得的结果往往偏高,其原因是受空气的影响,请用离子方程式表示产生这一影响的原因_______________________。