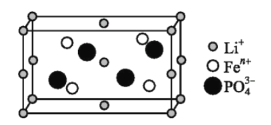
题目内容
【题目】根据下图所示实验,回答问题:
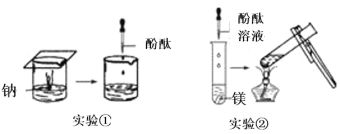
(1)实验①观察到的现象是________________________。
(2)实验②观察到的现象是________________________。

(3)实验③观察到的现象是________________________。实验④观察到的现象是________________________。
(4)由上述实验,你能得出的结论是________________________。
【答案】熔成小球,浮于水面,四处游动,有“嘶嘶”的响声,反应后溶液加酚酞变红 加热前镁条表面有少量无色气泡,加热沸腾后,有较多无色气泡冒出,溶液变粉红色 有无色气泡冒出,但试管中逸出气体的速率较快 有无色气泡冒出,但试管中逸出气体的速率较慢 钠、镁、铝置换水(或酸)中的氢由易到难的顺序是Na>Mg>Al。
【解析】
金属的通性:金属活泼性在氢前面的金属均可与水或酸反应置换出氢气,根据现象可判断金属活泼性的强弱。
(1)钠的熔点低,密度比水小,与水剧烈反应生成氢气和氢氧化钠,故现象为:钠熔成小球,浮于水面,四处游动,有“嘶嘶”的响声,反应后溶液加酚酞变红;
(2)镁在常温下与水反应不是很明显,仔细观察可看到有气泡产生;加热后生成氢气和氢氧化镁;现象为:加热前镁条表面有少量无色气泡,加热沸腾后,有较多无色气泡冒出,溶液变粉红色;
(3)金属活泼性在氢前面的金属均可与酸反应置换出氢气,金属性强弱:镁>铝,实验③④中都有无色气泡冒出,但放镁条的试管中逸出气体的速率较快;故答案为:有无色气泡冒出,但试管中逸出气体的速率较快;有无色气泡冒出,但试管中逸出气体的速率较慢;
(4)根据以上几组实验可知,钠与冷水反应剧烈,镁与冷水几乎不反应,能与热水反应;镁、铝都能置换出酸中的氢,镁更容易;即钠、镁、铝置换水(或酸)中的氢由易到难的顺序是Na>Mg>Al。

【题目】下表是某学生为探究AgCl沉淀转化为![]() 沉淀的反应所做实验的记录.
沉淀的反应所做实验的记录.
步骤 | 现象 |
Ⅰ | 立即产生白色沉淀 |
Ⅱ | 沉淀迅速变为黑色 |
Ⅲ | 较长时间后,沉淀变为乳白色 |
Ⅳ | 产生红棕色气体,沉淀部分溶解 |
Ⅴ | 产生白色沉淀 |
![]() 为了证明沉淀变黑是AgCl转化为
为了证明沉淀变黑是AgCl转化为![]() 的缘故,步骤I中NaCl溶液的体积范围为 ______ 。
的缘故,步骤I中NaCl溶液的体积范围为 ______ 。
![]() 已知:
已知:![]() 时
时![]() ,
,![]() ,此沉淀转化反应的平衡常数
,此沉淀转化反应的平衡常数![]() ______。
______。
![]() 步骤V中产生的白色沉淀的化学式为 ______ ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 ______。
步骤V中产生的白色沉淀的化学式为 ______ ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 ______。
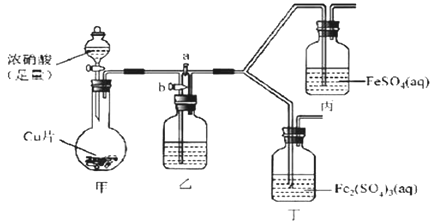
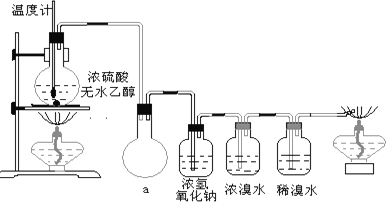
![]() 为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
![]() 装置A中玻璃仪器有圆底烧瓶、导管和 ______ ,试剂W为 ______ 。
装置A中玻璃仪器有圆底烧瓶、导管和 ______ ,试剂W为 ______ 。
![]() 装置C中的试剂为NaCl溶液和
装置C中的试剂为NaCl溶液和![]() 悬浊液的混合物,B中试剂为 ______ 。
悬浊液的混合物,B中试剂为 ______ 。
![]() 实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
完成C中反应的化学方程式:______Ag2S+_____NaCl+______ + ______ AgCl+S+ ______
______
C中NaCl的作用是: ______ 。
【题目】相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g) + 3Y2(g) ![]() 2XY3(g) △H=-92.6kJ/mol
2XY3(g) △H=-92.6kJ/mol
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q kJ |
下列叙述正确的是
A. 容器①、②中反应的平衡常数不相等
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol/L
C. 容器②中反应达到平衡时放出的热量为23.15kJ
D. 若容器①体积为0.20 L,则达平衡时放出的热量小于23.15 kJ