��Ŀ����
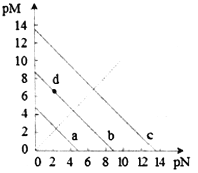
����Ŀ���ں��º��������£���һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2 L���ܱ������з�����Ӧ��N2O4(g)![]() 2NO2(g)����H>0����Ӧ�����и����ʵ����ʵ���Ũ��(c)��ʱ��(t)�ı仯������ͼ��ʾ��
2NO2(g)����H>0����Ӧ�����и����ʵ����ʵ���Ũ��(c)��ʱ��(t)�ı仯������ͼ��ʾ��
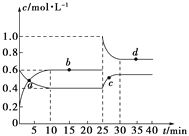
(1)���¶��£��÷�Ӧ��ƽ�ⳣ��Ϊ___________�����¶����ߣ�Kֵ��________(����������������С������������)��
(2)a��b��c��d�ĸ����У���ʾ��ѧ��Ӧ����ƽ��״̬����________�㡣����㿪ʼ�״δﵽƽ��ʱ����NO2��ʾ�ķ�Ӧ����Ϊ________��
(3)25 minʱ��������________(��������ʵĻ�ѧʽ����������ʵ���)��ʹƽ�ⷢ�����ƶ���
(4)d���ӦNO2�����ʵ���Ũ��_______(��������������С��������������)0.8 mol��L��1��������__________________________________________��
���𰸡� 0.9 ���� bd 0.04 mol��L��1��min��1 0.8 mol NO2 С�� ����ƽ��ʱ����������Ũ��Ϊ0.8 mol��L��1�����ʱQ��1.28>K��0.9��ƽ��Ҫ�����ƶ���ʹ����������Ũ�Ƚ��ͣ�����ƽ��ʱ����������Ũ��С��0.8 mol��L��1
����������1������ͼ����Ϣ��֪10minʱ��ƽ�⣬ƽ��ʱc(N2O4)=0.4mol/L��c(NO2)=0.6mol/L����K=![]() =0.9mol/L���÷�ӦΪ���ȷ�Ӧ�������¶����ߣ�Kֵ����2����ͼ��֪10-25minƽ��״̬ʱ��X��ʾ���������Ũ�ȱ仯��Ϊ��0.6-0.2��mol/L=0.4mol/L��Y��ʾ�ķ�Ӧ���Ũ�ȱ仯��Ϊ��0.6-0.4��mol/L=0.2mol/L��X��ʾ���������Ũ�ȱ仯����Y��ʾ�ķ�Ӧ���Ũ�ȱ仯����2��������X��ʾNO2Ũ����ʱ��ı仯���ߣ�Y��ʾN2O4Ũ����ʱ��ı仯���ߣ�����㿪ʼ�״δﵽƽ��ʱ����NO2��ʾ�ķ�Ӧ����Ϊ
=0.9mol/L���÷�ӦΪ���ȷ�Ӧ�������¶����ߣ�Kֵ����2����ͼ��֪10-25minƽ��״̬ʱ��X��ʾ���������Ũ�ȱ仯��Ϊ��0.6-0.2��mol/L=0.4mol/L��Y��ʾ�ķ�Ӧ���Ũ�ȱ仯��Ϊ��0.6-0.4��mol/L=0.2mol/L��X��ʾ���������Ũ�ȱ仯����Y��ʾ�ķ�Ӧ���Ũ�ȱ仯����2��������X��ʾNO2Ũ����ʱ��ı仯���ߣ�Y��ʾN2O4Ũ����ʱ��ı仯���ߣ�����㿪ʼ�״δﵽƽ��ʱ����NO2��ʾ�ķ�Ӧ����Ϊ![]() =0.04 mol��L��1��min��1����ͼ��֪��10-25min��35min֮��X��Y�����ʵ����������仯������Ӧʱ����ڵĵ㴦�ڻ�ѧƽ��״̬����b��d���ڻ�ѧƽ��״̬����3��25minʱ��c��NO2��˲������ƽ��״̬�����ˣ�1-0.6����2=0.8mol ����c��NO2����ƽ��������N2O4�����ƶ�����4����ƽ��ʱ����������Ũ��Ϊ0.8 mol��L��1�����ʱQ��1.28>K��0.9��ƽ��Ҫ�����ƶ���ʹ����������Ũ�Ƚ��ͣ�����ƽ��ʱ����������Ũ��С��0.8 mol��L��1 ��
=0.04 mol��L��1��min��1����ͼ��֪��10-25min��35min֮��X��Y�����ʵ����������仯������Ӧʱ����ڵĵ㴦�ڻ�ѧƽ��״̬����b��d���ڻ�ѧƽ��״̬����3��25minʱ��c��NO2��˲������ƽ��״̬�����ˣ�1-0.6����2=0.8mol ����c��NO2����ƽ��������N2O4�����ƶ�����4����ƽ��ʱ����������Ũ��Ϊ0.8 mol��L��1�����ʱQ��1.28>K��0.9��ƽ��Ҫ�����ƶ���ʹ����������Ũ�Ƚ��ͣ�����ƽ��ʱ����������Ũ��С��0.8 mol��L��1 ��

 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д�